【大学/薬学部】有機化学ミニ講義 共鳴構造式①
今回は共鳴構造式について説明します。
2つの記事に分けて投稿します。
① 共鳴構造式の基本
② 第101薬剤師国家試験の問8を解きながら補足
それでは、早速始めていきましょう。
下に示したのは酢酸イオンの構造です。

今回のテーマである共鳴構造式に深く関係しているのは、酢酸イオンの右側部分です。
右側の部分に着目して考えていきましょう。
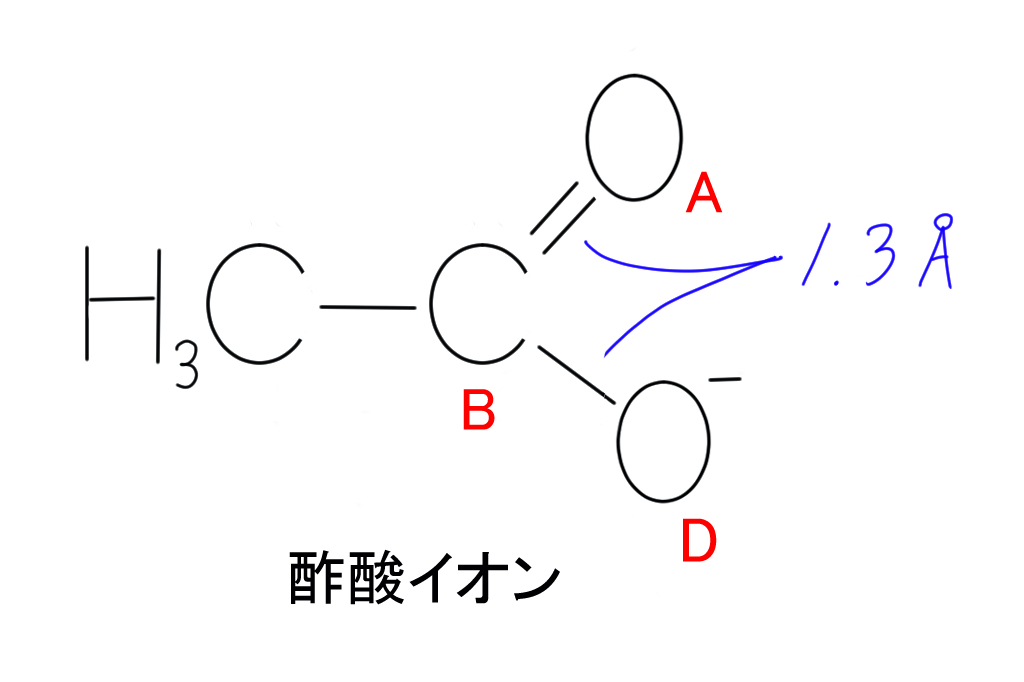
酸素原子Aは炭素原子Bと二重結合を形成しています。
その一方で、酸素原子Dは炭素原子Bと単結合を形成していますよね。
二重結合と単結合なので、これら2つの結合の長さは違うはずです。
一般的に、単結合よりも二重結合の方が短いです。
炭素-酸素二重結合(C=O)の標準的な結合距離は1.22 Åぐらいで、炭素-酸素単結合(CーO)は1.43 Åぐらいです。
しかしながら実際のところ、酢酸イオンのA-B間の二重結合とB-D間の単結合は長さが等しいことが分かっています。
ちなみに、これらの長さは上の図に示したとおり1.3 Åです。
これは一体どういうことなのでしょうか?
どちらの結合も長さが同じということは、上に示した酢酸イオンの構造が、真の構造を表現できていないことを示しています。
このことについて、もっと深く考えていきましょう。
じつは、この構造には、もう1つ別の書き方があります。

左側が先ほど示した構造で、右側がもう1つの別の書き方です。
A-B間とB-D間の二重結合と単結合が逆になったパターンの書き方ですね。
右側のパターンで書いた場合も二重結合と単結合が1つずつありますので、両方とも1.3 Åという事実と辻褄が合いません。
酢酸イオンの真の構造に近づけるためには、下に示したように表現するのが適切でしょう。

青い矢印で示した部分が点線になりました。
これらの点線の結合は、あえて言うなら「0.5重結合」と言ったところです。
そうなりますと、A-B間とB-D間の結合は、単結合と二重結合の間をとって、1.5重結合になります。
下に示した左もしくは右の構造の、青い円で囲った結合1つ分を半々にしたわけですね。
点線を使って書いた構造は、左と右の構造を足して2で割ったようなものです。
実際、この1.3 Åという値は、単結合(1.43 Å)と二重結合(1.22 Å)の中間ぐらいの長さですよね。

ここで、あらめて真の構造に近づけた構造を下に示します。

マイナスの電荷も半分半分になっており、1/2マイナスと1/2マイナスです。
この表現なら、A-B間の結合とB-D間の結合が同じ長さである……という事実と矛盾しません
このように、真の構造を適切に表現することができましたが、点線と1/2マイナスで表現した構造は、最初に示した2つの構造(単結合と二重結合がハッキリ区別できる書き方)と比べると、なかなか複雑で分わかりづらいですよね。
分かりやすい2つの構造を使って、真の構造を表現したいところです。
そのような方法があります。
それは、2つの構造の間に下記のような両開きの矢印(両矢印)を書く……という方法です。

この式が、今回のテーマである共鳴構造式になります。
共鳴構造式は角(かく)カッコ[]で括るのが一般的です。
そして、左と右の各々の構造を極限構造式と呼びます。
なお、極限構造式のことも「共鳴構造式」とか「共鳴構造」と言うこともあります。
ややこしいので、私の記事では、全体の式を共鳴構造式、各構造を極限構造式と呼びますね。
さて、もう少し共鳴構造式について考えていきましょう。
共鳴構造式を書く際には、極限構造式から極限構造式への電子の動きを、巻矢印(まきやじるし)で表すことができます。
まずは、省略されている非共有電子対をしっかりと書きましょう。

非共有電子対を省略したままでも電子の動きを表現できますが、大学の有機化学を勉強し始めた最初のうちは省略せずに全て書き出した方が理解しやすくなります。
そして、左側の構造の酸素原子Dが持ついずれかの非共有電子対を、DとBを繋ぐ単結合の上に移動させます。
この動きを、下図の青色で示したような巻矢印で表現します。

続いて、炭素Bと酸素Aを結ぶ二重結合のうち、一方の結合を酸素原子Aの方に移動させます。
ここで右側の構造を見てみると、電子が移動することによりBーD間の炭素-酸素結合が二重結合になっており、酸素原子Dの非共有電子対が1組減っていることが分かりますよね。その一方で、酸素原子Aには、非共有電子対が1組増え、BーA間の炭素ー酸素結合が単結合になっていることが分かります。
ちなみに、右側から左側の極限構造式への電子の動きも書くなら、下の図の青色の巻矢印のようになります。

このようにして表現した電子の動きを追いながら、これら2つの極限構造式を行ったり来たりしてみると、この共鳴構造式全体で真の構造(上述の点線と1/2マイナスで表現した構造)を表現していることが分かりますよね。
各々の極限構造式は真の構造ではありません。下図の紫色で囲んだ辺りの電子を、一方の酸素原子に向かってあえて寄せた描き方です。

一方の酸素原子とは、下記の青い矢印で示した酸素原子のことです。

一方の酸素原子がマイナスで、単結合と二重結合を1つずつ持つ分かりやすい構造ですよね。
有機化学では多くの場合、こちらの分かりやすい構造を使って反応のメカニズムや化合物の性質を考えます。
というわけで共鳴構造式は、分かりやすい極限構造式を両矢印で関連付け、真の構造を表現する式だったというわけです。
さて、共鳴構造式を学ぶ上で、大事なことがあります。
それは、共鳴構造式が書ける、つまり、極限構造式がいくつか書けると、その化合物は安定化する……ということです。
共鳴構造式が書けるということは、電子がより広い空間に広がっており、電荷が広く分散しているということになります。
電荷あるいは電子が非局在化している……と言います。
こうなると、その化合物は安定化します。
この考え方は今後、重要になってくるので覚えておいてください。
例えば、酢酸とエタノールの酸性度の違いは、共鳴による安定化で説明されることが多々あります。

エタノールのプロトンを引き抜くためには、NaOHなど、比較的強い塩基が必要になります。
一方、酢酸のプロトンは、NaHCO3など、NaOHより弱い塩基でも引き抜けます。
酢酸がエタノールよりも脱プロトン化しやすいのは、プロトンを放出した後の、酢酸イオンの共鳴構造式が書けること、つまり電荷が非局在化していることが要因の一つと言えるわけです。
エタノールが脱プロトン化されて生じるエトキシドイオンは、共鳴構造式が書けませんよね。
今回の記事はこれで終わりです。
次の記事では、薬剤師国家試験の問題を通して共鳴構造式を勉強します。
chemist-programming.hatenablog.jp
---
興味のある方は是非どうぞ↓
【大学/薬学部】有機化学ミニ講義 ルイス構造式③
前回の記事(形式電荷について)↓
chemist-programming.hatenablog.jp
今回は、問題を解きながら、ルイス構造式と形式電荷について理解を深めていきたいと思います。
第105回薬剤師国家試験の問6です。

選択肢には、炭素原子1つと水素原子を3つもつ様々な構造が並んでいます。
まずは、これらに水素原子が1つ増えた化合物であるメタン(CH4 )について考えてみましょう。
シンプルな化合物から考えていくと、理解しやすくなると思います。
メタンのルイス構造式を下に示します。

炭素原子は、原子番号が6番なので、陽子の数が6コ、電子の数も6コです(もし原子番号が分からなくなったら周期表を思い出しましょう)。
これらの電子は、1s軌道に2コ、2s軌道に2コ、2p軌道に2コ入っています。
下記のとおり1s軌道の電子は結合形成に使われないので、2s軌道と2p軌道に入っている合計4つの電子が結合に使われる可能性があります。


炭素原子と水素原子でシェアしている8つの電子を半々にし、メタンの炭素原子に属している電子を数えてみましょう。
下に示したように4つですよね。

炭素原子が元々もつ価電子の数と同じですので、もちろん、プラスやマイナスの形式電荷は必要ありません。
これを踏まえて設問に入っていきましょう。
まずは1番の選択肢から考えていきます。
1番の選択肢では、 下に示したように炭素原子に属している電子が5個ですので、元々の価電子の数である4コよりも1つ多いですよね。

そのため、電子の数が陽子の数を上回ることになるので、形式電荷はプラスではなくマイナスを記載します。
詳しく数えると、炭素原子は陽子が6コで、電子は価電子の5コと1s軌道の2コで合計7コですよね。
1番の選択肢では、そもそも電子配置と形式電荷の関係が間違っています。
2番の選択肢の構造は正しい形式電荷が書かれていて、これをメチルアニオンと呼びます。
ただし、正解であるメチルカチオンではないので2番の選択肢も×です。

続いて3番です。
3番の炭素原子に属している電子の数は4個です。

元々の炭素原子の価電子と同じ数ですね。
陽子と電子の数が同じということは形式電荷が0であるため、プラスやマイナスは書きません。
というわけで、3番については電子配置と形式電荷の関係が合っていますね。
ちなみに、この構造はメチルラジカルという名前です。
構造に間違いはありませんが、メチルカチオンではないので×です。
続いて4番です。
4番については、下に示したように炭素原子に属している電子の数が3個です。

元々の炭素原子の価電子(4コ)よりも電子の数が1コ少なくなっています。
陽子の数が1コ多いため、プラスの形式電荷を書く必要があります。
したがって、3番の選択肢については電子配置と形式電荷は正しいです。
カチオンはプラスに帯電しているもののことを指すので、これがメチルカチオンであり正解になります。
なお、5番の構造は4番のものと同じ電子配置ですが、形式電荷がマイナスなので間違っていますね。
以上、ルイス構造式のミニ講義を3回にわけて記事にしました。
ルイス構造式が書けて、かつ形式電荷を正しく書けるようになれればOKです。
そのためにはまず、原子ごとに価電子の数を思い出せるようにしておく必要があります。
個人的には、周期表をある程度覚えて、電子の数をいつでも思い出せるようにしておくのが、一番楽だと思います。
原子番号 = 電子の数 = 陽子の数ですので、原子番号が分かれば思い出せます。
そこから電子配置を考えて、価電子の数を導きましょう。
ルイス構造式に関連した過去の記事のリンクを下に載せておきますので、合わせてご覧いただければと思います。
chemist-programming.hatenablog.jp
chemist-programming.hatenablog.jp
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ
(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198922.html)
【大学/薬学部】有機化学ミニ講義 ルイス構造式②
前回の記事(ルイス構造式の基本)↓
chemist-programming.hatenablog.jp
前回は、ルイス構造式について基本的なことを述べました。
この記事では、電荷をもつイオンのルイス構造式を見ていきます。
プラスあるいはマイナスの形式電荷を理解しておかないと、反応機構を書いているときに分からなくなってしまうことがあるので、しっかり確認していきましょう。
イオンの例として、下にアンモニウムイオンを示しています。

窒素の近くにプラスの形式電荷が書かれていますよね。
このような形式電荷を書くのか、書かないのか、あるいは、プラスなのかマイナスなのかを判断する際は、まず、対象となっている原子が元々いくつ価電子をもっていたのかを思い出して下さい。
窒素原子の場合、下記のように元々5個の価電子をもっていましたよね。
なぜ5個なのか分からなくなったら前回の記事を参照にして下さい。

続いて、アンモニウムイオンの窒素原子に属している電子を数えてみましょう。
どういうことかと言うと、水素原子と窒素原子でシェアしている8つの電子を半々にして数える……ということです。
次のように、もともと電子を持っていた各々の原子のところに返してみます。

この状態で改めて窒素がもっている電子を数えていきます。
このようにして数えてみると、窒素原子に属している電子は4つ……ですよね。
もとの窒素原子の価電子(上記参照)や、アンモニア(下記参照)のときと比べて、電子が1コ減ってしまっています。

アンモニウムイオンの窒素原子に属している電子が1コ減ってしまったので、この窒素原子は陽子が1コ多い状態になります。
陽子は7個のままで、電子は上に示したように4コと1s軌道の2個で合計6個ですよね。
もちろん、陽子は正電荷……つまりプラスの電荷をもち、電子は負電荷……つまりマイナスの電荷をもちます。
そのため、陽子が1コ余っているアンモニウムイオンの窒素原子には、プラスと書いておくわけです。
さて、もう1例、考えていきましょう。
今度はオキソニウムイオンと呼ばれるイオンです。
水分子がプロトン化されたものですよね。

酸素原子の価電子は6コです。

それでは、先ほどと同じようにオキソニウムイオンの酸素原子に属している電子を数えてみましょう。

この図で示したように、5コですよね。
元々の酸素原子の価電子と比較して、1コ少なくなっています。
そのため、アンモニウムイオンのときと同様に、陽子が1コ余ることになるので、プラスの形式電荷を書いておくというわけです。
窒素原子は陽子を8コ持っており、電子は上に示した5コと1s軌道の2コで合計7コです。
陽子が1コ余っていますよね。
今回、紹介したのは簡単な化合物のみですが、複雑になってくると、形式電荷がよく分からなくなってくることもあります。
混乱したら、簡単な化合物に戻って復習していただければと思います。
次の記事では、薬剤師国家試験の問題を通してルイス構造式と形式電荷について解説します。
chemist-programming.hatenablog.jp
---
興味のある方は是非どうぞ↓
【大学/薬学部】有機化学ミニ講義 ルイス構造式①
大学の有機化学について基礎的なところから順々に説明していこうと思っています。
まずは、ルイス構造式について説明していきますね。
3つの記事に分けて投稿します。
① ルイス構造式の基本
② 電荷をもつルイス構造式
③ 第105薬剤師国家試験の問6を解きながら補足
それでは早速、ルイス構造式の基本的なところから見ていきましょう。
始めに、とても簡単な分子である H2(水素分子)について解説します。
ルイス構造式を書くために、まずは水素原子Hが結合に使われる電子を何個もっているのかを確認する必要があります。
結合に使われる電子とは……最外殻の電子のことです。
最外殻にある電子を、「価電子」と呼ぶんでしたね。
価電子がいくつあるのか知るためには、原子番号を確認するのがてっとり早いです。
水素の原子番号は1番ですよね。

水素原子を模式的な図で表してみると、下のように陽子を1コ、電子を1コ持っています。

水素原子の場合、この1コが価電子になります。
1s軌道に入っている電子です。
下記のように、2つの水素原子(H)が電子を1つずつ出し合い、水素分子(H2)ができあがります。

今回のテーマである「ルイス(Lewis)構造式」は、このように電子を黒い点で表したものです。
水素分子中の2つの黒い点を1本の線で表すと、下に示したよく見る構造式になります。

こちらの構造式(ちなみに、ケクレ(Kekulé)構造式と呼びます)の方がよく使われると思いますが、有機化合物の構造をしっかりと深く理解するためにはルイス構造式が必要になってきます。
続いて、水分子 H2O のルイス構造式について考えていきましょう。

水素原子については先ほど考えましたので、今度は酸素原子について考えます。
酸素は原子番号が8番です。
ということは、電子を8コ、陽子を8コもっているということですよね(もちろん中性子もあります)。
さて、電子について詳しく見ていきましょう。
1s軌道に2コ、2s軌道に2コ、2p軌道には4コの電子があります。

カッコの中は軌道の名称、上付きの数字はその軌道に入っている電子の数を表しています。
結合の形成に使われる可能性がある電子は、2s軌道の電子2コと2p軌道の電子4コ……つまり、合計6コです。
2コの電子が入っている1s軌道は、貴ガス(希ガス)であるヘリウム He の電子の構造と同様で安定であり、結合には使われません。

酸素原子と結合する水素原子は2コですので、結合に使われる6コの電子のうちの2コの電子が、水素原子との結合形成に使われます。
残りの4コの電子は非共有電子対になる……というわけです。
改めて、水分子 H2O のルイス構造式を下に示します。
結合に使われた2コの電子と、使われなかった4コの電子を確認しておきましょう。

最後に、アンモニア(NH3)について考えていきます。

窒素原子が登場しましたね。
窒素の原子番号は7番です。
というわけで、窒素は陽子を7コ、電子も7コもっています。
これら7コの電子は、1s軌道に2コ、2s軌道に2コ、2p軌道に3コ入っています。

先ほどと同様に、1s軌道の2の電子は結合に使われないので、結合に使われる可能性のある電子は5コですよね。
アンモニアの水素原子は3コですので、このうちの3コの電子が結合に使われていて、残りの2コは非共有電子対になるわけです。
改めて、アンモニア分子のルイス構造式を示しておきます。

さて、さらに注目して欲しいことがあります。
それは、NH3の窒素原子の周りには電子が8コある……ということです。
先ほどのH2Oの酸素原子も、やはり周りに8コの電子をもっていました。
両者とも貴ガスで言うところのNeの電子配置[(1s)2 (2s)2 (2p)6]と同様の電子配置になっており安定しているわけです。

これを「オクテット則」と言うんでしたね。
オクテット(octet)は『8個でひとまとまり』という意味です。
「8電子則」と呼ぶこともあります。
オクテット則は、主に第2周期の元素に当てはまりますが、例外もあります。
とくに第3周期になるとd軌道があるので結構複雑になってオクテット則に当てはまるときと当てはまらないときがあるので、ご注意ください。
これで今回の話は終わりです。
次の記事では、電荷をもつルイス構造式について解説していきます。
chemist-programming.hatenablog.jp
---
興味のある方は是非どうぞ↓
【薬剤師国家試験 第102回 問211】β-ラクタム系抗菌薬とプロドラッグについて理解しよう

それでは早速、選択肢を見ていきましょう。
【1】……この骨格はペネムではなくてセフェムですので、×です。
下に示した4つの骨格は、とくに有名なので覚えておきましょう。

【2】……4員環は歪んでいるため、開環しやすいです。
つまり、β-ラクタム環のカルボニル炭素は求核攻撃を受けやすいということです。
求核攻撃を受けると、アミド結合が切断され、4員環が開環するわけですね。
求核攻撃を受けやすいということは、β-ラクタム環のカルボニル炭素の求電子性は高くなっていることになります。
したがって、【2】は×です。
【3】……この記述は、まさにβ-ラクタム系抗菌薬のメカニズムですので、この選択肢は正しいです。
選択肢の【2】で述べたように、β-ラクタム環のカルボニル基は反応性が高いです。
このカルボニル基が、酵素のセリン残基、つまり水酸基と反応し、酵素が阻害されます。
その様子を下に示しました。

セリンの酸素原子とカルボニル炭素が共有結合を形成し、β-ラクタム環は開環していますね。
【4】……確かに、カルボキシル基がエステル化されている構造があるため、プロドラッグである可能性があります。

カルボン酸のように水溶性が高いと、小腸の粘膜から吸収されにくくなります。
細胞膜は脂質二重層になっているんでしたね。
水溶性が高いと細胞膜を通り抜けづらいのですが、脂溶性の高い低分子は通過しやすいです。
カルボキシル基をエステル化してしまえば、カルボン酸としての性質は失われ、脂溶性が高まるわけです。
その結果、小腸の粘膜から吸収されやすくなるので、経口吸収性が改善されます。
したがって、【4】の記述は正しいです
【5】……結論から言うと、セフジトレン ピボキシルは酢酸を生じるような構造はもっていないため、この記述は間違いです。
「ピバル酸」がどのような構造をもつのかは、「2,2-dimethylpropanoic acid」という名称から分かりますね。
Propanoic acid、つまりプロピオン酸は、炭素数3つのカルボン酸です。
その2位にメチル基が2つ置換しているので、下に示した構造になります。

ピバル酸の部分は、セフジトレン ピボキシルの中の下記に示した構造に相当することが分かると思います。

【5】の設問に書いてあるように、セフジトレン ピボキシルが加水分解されると、どのような化合物が生じるでしょうか?
エステル構造は2つあります(セフジトレン ピボキシルの右上に二か所)。
生体内でどちらが優先的に加水分解されるのかは分かりませんが、生じる化合物は同じものです。
それでは、2通りのエステルの加水分解について見ていきましょう。

反応機構を書いている途中で、ヘミアセタールの部分構造が生じたら、そのまま分解させてください。
特別なケースでない限り、このような構造は不安定です。
この反応機構が示すとおり、ピバル酸とともにホルムアルデヒドが生じます。
やはり酢酸は生成しませんので、【5】の記述は×です。
それでは、もう一つのパターンも見ていきましょう。
下記のように、セフェム骨格に直接結合しているエステルが加水分解されるパターンです。

加水分解のメカニズムがこちらのパターンであったとしても、最終的にホルムアルデヒドとピバル酸が生成していますね。
生体内で、どちらの経路により加水分解されているのかは分かりませんが、生じる化合物は同じでした。
以上のことから、正解は【3】と【4】です。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問209】グルタチオンはメルカプト基が反応する


アセトアミノフェンとAが反応して生じる付加体を、選択肢の中から選んでいきましょう。
グルタチオンの大きな特徴は、メルカプト基(–SH)が反応することです。
この官能基は、代謝物Aのどの位置に反応するのでしょうか?
前問では、チオール(-SHをもつ化合物のこと)がエノン構造に1,4-付加(Michael付加)することを述べました。
代謝物Aはエノン構造をもつので、グルタチオンがAに1,4-付加する可能性が充分にあります。
しかしながら、選択肢の中には、そのような結合パターンをもつ(カルボニル酸素から数えて4番目の位置(カルボニル基のβ位)に硫黄原子Sが結合している)化合物はありません。

代謝物Aはエノン構造をもってはいますが、エノンと同様の性質は示さない……ということなのでしょう。
代謝物Aのエノン構造は、イミン部位およびオレフィンとつながって(共役して)いるので、性質が異なるということだと思います。
有機化合物において、周辺の構造が少し変化すると官能基の反応性も変わる……というのは、よくあることです。
前の問題のように、チオールがエノン構造に1,4-付加することが分かっているだけでは、正解に辿り着くことが困難です。*1
2つの反応物から考えて答えが出せないようであれば、選択肢の構造(=生成物の構造)から、考えていきましょう。
メルカプト基(–SH)が反応しているのは、4番と5番の化合物だけですね。
まずは、4番の化合物の構造をよく見てみましょう。
エノンの酸素原子が窒素原子に変わった下記の構造(Aの桃色の線で囲った部分)に1,4-付加した……と考えると、分かりやすいと思います。
細かいところは異なるかもしれませんが、反応機構の流れも示していますので、確認していきましょう。

まず、メルカプト基が付加した後、プロトンが移動します(B→C)。
続く互変異性化でケト型(Cの緑色の線で囲った部分)からエノール型に変換されれば、ベンゼン環が生じます(C→4)。
芳香族化合物は安定なので、普通は不安定なエノール型に落ち着くわけですね。
一方、構造上部にある窒素原子の周辺は、より安定な、アミノ基がアセチル化された形(4の赤色の線で囲った部分)に互変異性化します(C→4)。
この変換は、エノール型からケト型に変換される様子と似ています(構造的には、炭素原子が窒素原子に置き換わった形になります)。
以上の変換により、4番の化合物に変換されました。
答えに辿り着くことができましたが、一応、5番の化合物が生成する可能性も考えてみましょう。
5番の化合物が生成するのであれば、メルカプト基がエノン構造に対して1,2-付加したことになります。
この化合物Aに関しては周辺の構造の影響によって、1,2-付加が優先するのかもしれません。
こちらの反応機構も書いてみましょう。

グルタチオンがAに付加すると、メルカプト基のプロトンが移動して、DからEが生じるでしょう。
これ以上は反応機構を書き進めることができず、5番の化合物には至りませんよね。
したがって、正解はやはり4番の選択肢です。
代謝物Aとグルタチオンの反応は、生体内で起こる反応です。
なかなか反応形式を見破るのが難しいところですが、反応機構を書くことに慣れておくと、得点に結びつくかもしれません。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問207】チオールはエノンに1,4-付加(Michael付加)する

メスナとアクロレインが反応して、生成する化合物Aの構造を5つの選択肢の中から選ぶ問題です。
メスナの右端の部分は非常に強い酸(スルホン酸)の共役塩基です。
そのため、この部分の反応性はとても低いです。
反応に関わるのはチオールの部分(メルカプト基)で、アクロレインのエノン部位と反応します。
一般的にチオールは、エノンに対して1,2-付加よりも1,4-付加を優先的に起こします。
第104回、問209の余談で述べたように、チオールはエノンに1,4-付加(Michael付加)します。*1

このことを踏まえて、問題を解いてみましょう。
細かいところは異なるかもしれませんが、反応機構の大筋は下記のとおりです。

まず、チオールの硫黄原子がエノンの4と書かれた炭素原子に付加します。
続いて、チオール部位(-SH)のプロトンの移動を経て、エノールが生じます。
最後に、エノール型から安定なケト型への互変異性化が起こります。
1,4-付加した後は、元々あった3位と4位を結ぶ二重結合がなくなるので、ご注意ください。
というわけで、5番の化合物ではなく1番の化合物が生成します。
以上のように、正解は1番の化合物でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)