今回は共鳴構造式について説明します。
2つの記事に分けて投稿します。
① 共鳴構造式の基本
② 第101薬剤師国家試験の問8を解きながら補足
それでは、早速始めていきましょう。
下に示したのは酢酸イオンの構造です。

今回のテーマである共鳴構造式に深く関係しているのは、酢酸イオンの右側部分です。
右側の部分に着目して考えていきましょう。
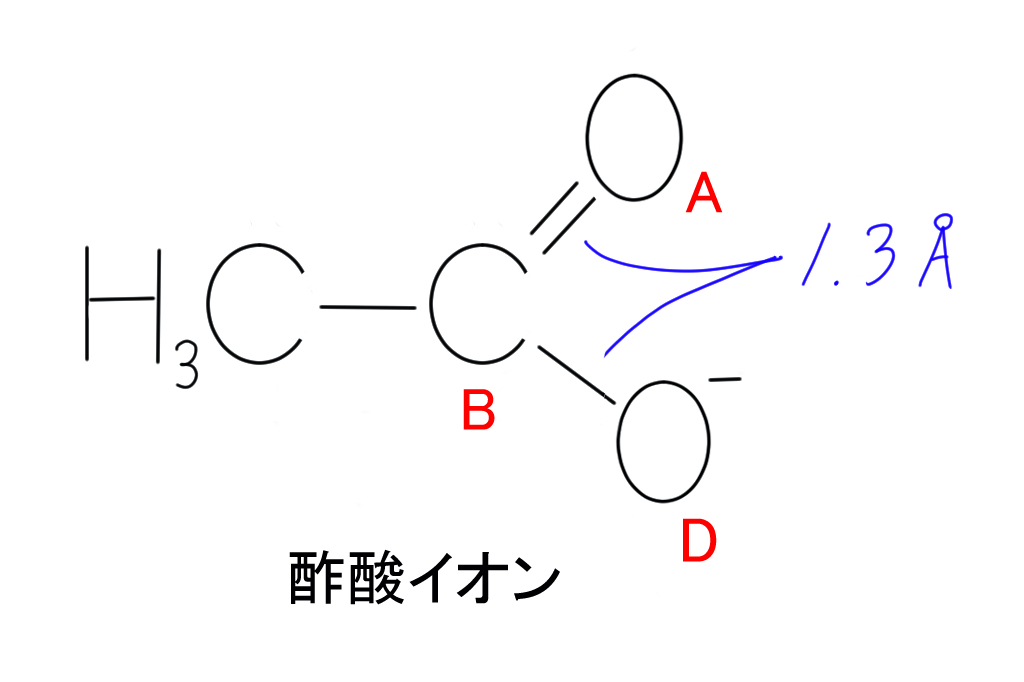
酸素原子Aは炭素原子Bと二重結合を形成しています。
その一方で、酸素原子Dは炭素原子Bと単結合を形成していますよね。
二重結合と単結合なので、これら2つの結合の長さは違うはずです。
一般的に、単結合よりも二重結合の方が短いです。
炭素-酸素二重結合(C=O)の標準的な結合距離は1.22 Åぐらいで、炭素-酸素単結合(CーO)は1.43 Åぐらいです。
しかしながら実際のところ、酢酸イオンのA-B間の二重結合とB-D間の単結合は長さが等しいことが分かっています。
ちなみに、これらの長さは上の図に示したとおり1.3 Åです。
これは一体どういうことなのでしょうか?
どちらの結合も長さが同じということは、上に示した酢酸イオンの構造が、真の構造を表現できていないことを示しています。
このことについて、もっと深く考えていきましょう。
じつは、この構造には、もう1つ別の書き方があります。

左側が先ほど示した構造で、右側がもう1つの別の書き方です。
A-B間とB-D間の二重結合と単結合が逆になったパターンの書き方ですね。
右側のパターンで書いた場合も二重結合と単結合が1つずつありますので、両方とも1.3 Åという事実と辻褄が合いません。
酢酸イオンの真の構造に近づけるためには、下に示したように表現するのが適切でしょう。

青い矢印で示した部分が点線になりました。
これらの点線の結合は、あえて言うなら「0.5重結合」と言ったところです。
そうなりますと、A-B間とB-D間の結合は、単結合と二重結合の間をとって、1.5重結合になります。
下に示した左もしくは右の構造の、青い円で囲った結合1つ分を半々にしたわけですね。
点線を使って書いた構造は、左と右の構造を足して2で割ったようなものです。
実際、この1.3 Åという値は、単結合(1.43 Å)と二重結合(1.22 Å)の中間ぐらいの長さですよね。

ここで、あらめて真の構造に近づけた構造を下に示します。

マイナスの電荷も半分半分になっており、1/2マイナスと1/2マイナスです。
この表現なら、A-B間の結合とB-D間の結合が同じ長さである……という事実と矛盾しません
このように、真の構造を適切に表現することができましたが、点線と1/2マイナスで表現した構造は、最初に示した2つの構造(単結合と二重結合がハッキリ区別できる書き方)と比べると、なかなか複雑で分わかりづらいですよね。
分かりやすい2つの構造を使って、真の構造を表現したいところです。
そのような方法があります。
それは、2つの構造の間に下記のような両開きの矢印(両矢印)を書く……という方法です。

この式が、今回のテーマである共鳴構造式になります。
共鳴構造式は角(かく)カッコ[]で括るのが一般的です。
そして、左と右の各々の構造を極限構造式と呼びます。
なお、極限構造式のことも「共鳴構造式」とか「共鳴構造」と言うこともあります。
ややこしいので、私の記事では、全体の式を共鳴構造式、各構造を極限構造式と呼びますね。
さて、もう少し共鳴構造式について考えていきましょう。
共鳴構造式を書く際には、極限構造式から極限構造式への電子の動きを、巻矢印(まきやじるし)で表すことができます。
まずは、省略されている非共有電子対をしっかりと書きましょう。

非共有電子対を省略したままでも電子の動きを表現できますが、大学の有機化学を勉強し始めた最初のうちは省略せずに全て書き出した方が理解しやすくなります。
そして、左側の構造の酸素原子Dが持ついずれかの非共有電子対を、DとBを繋ぐ単結合の上に移動させます。
この動きを、下図の青色で示したような巻矢印で表現します。

続いて、炭素Bと酸素Aを結ぶ二重結合のうち、一方の結合を酸素原子Aの方に移動させます。
ここで右側の構造を見てみると、電子が移動することによりBーD間の炭素-酸素結合が二重結合になっており、酸素原子Dの非共有電子対が1組減っていることが分かりますよね。その一方で、酸素原子Aには、非共有電子対が1組増え、BーA間の炭素ー酸素結合が単結合になっていることが分かります。
ちなみに、右側から左側の極限構造式への電子の動きも書くなら、下の図の青色の巻矢印のようになります。

このようにして表現した電子の動きを追いながら、これら2つの極限構造式を行ったり来たりしてみると、この共鳴構造式全体で真の構造(上述の点線と1/2マイナスで表現した構造)を表現していることが分かりますよね。
各々の極限構造式は真の構造ではありません。下図の紫色で囲んだ辺りの電子を、一方の酸素原子に向かってあえて寄せた描き方です。

一方の酸素原子とは、下記の青い矢印で示した酸素原子のことです。

一方の酸素原子がマイナスで、単結合と二重結合を1つずつ持つ分かりやすい構造ですよね。
有機化学では多くの場合、こちらの分かりやすい構造を使って反応のメカニズムや化合物の性質を考えます。
というわけで共鳴構造式は、分かりやすい極限構造式を両矢印で関連付け、真の構造を表現する式だったというわけです。
さて、共鳴構造式を学ぶ上で、大事なことがあります。
それは、共鳴構造式が書ける、つまり、極限構造式がいくつか書けると、その化合物は安定化する……ということです。
共鳴構造式が書けるということは、電子がより広い空間に広がっており、電荷が広く分散しているということになります。
電荷あるいは電子が非局在化している……と言います。
こうなると、その化合物は安定化します。
この考え方は今後、重要になってくるので覚えておいてください。
例えば、酢酸とエタノールの酸性度の違いは、共鳴による安定化で説明されることが多々あります。

エタノールのプロトンを引き抜くためには、NaOHなど、比較的強い塩基が必要になります。
一方、酢酸のプロトンは、NaHCO3など、NaOHより弱い塩基でも引き抜けます。
酢酸がエタノールよりも脱プロトン化しやすいのは、プロトンを放出した後の、酢酸イオンの共鳴構造式が書けること、つまり電荷が非局在化していることが要因の一つと言えるわけです。
エタノールが脱プロトン化されて生じるエトキシドイオンは、共鳴構造式が書けませんよね。
今回の記事はこれで終わりです。
次の記事では、薬剤師国家試験の問題を通して共鳴構造式を勉強します。
chemist-programming.hatenablog.jp
---
本ブログの管理人が薬の書籍を執筆しました↓(2024年9月発売)
薬理学を丁寧に説明しましたので、是非よろしくお願いします!
現在、楽天ブックスで管理人の書籍『ノーベル化学賞に輝いた研究のすごいところをわかりやすく説明してみた』が45%OFFで購入できます↓(2024年12月25日11:59まで)
こちらの書籍もよろしくお願いします! *売り切れ注意*
実験動物においてがん細胞の観察を可能にした「緑色蛍光タンパク質(GFP)」の発見経緯と光るメカニズム、国試の範囲でもある「質量分析」の基本と「MALDI」の解説、有機化学の発展内容(鈴木・宮浦カップリングと不斉合成)など、薬学部に関係のあることが盛りだくさんです。
興味のある方は是非どうぞ↓
