【大学/薬学部】有機化学ミニ講義 共鳴構造式②
前回の記事(共鳴構造式の基本について)↓
chemist-programming.hatenablog.jp
今回は問題を解きながら、共鳴構造式の様々な例を見ていきましょう。
第101回薬剤師国家試験の問8です。

選択肢は、全部で5つあります。
1番のカルボキシラートイオンは、前回の記事で紹介しました。
非共有電子対が省略されて書かれていますが、この状態でも次のように巻矢印を書くことができます。

むしろ、こちらの書き方のほうが頻繁に見かけると思います。
ただ、最初のうちは下記のように非共有電子対を省略しないで、きちんと書くことをオススメしますね。
複雑な化合物になってくると、訳が分からなくなってきてしまいます。

もちろん1番は正しい共鳴構造式です。
続いて、2番の化合物はアセトンです。
非共有電子対を省略せずに巻矢印を書いてみましょう。

二重結合の電子が酸素原子の方に移動し、酸素原子がもつ非共有電子対が1組増えます。
もともと二重結合だったところは単結合になっていますね。
右側から左側の極限構造式に向かう巻矢印は、酸素原子の非共有電子対がCーO結合のところに移動するように書きます。
2番も正しい共鳴構造式です。
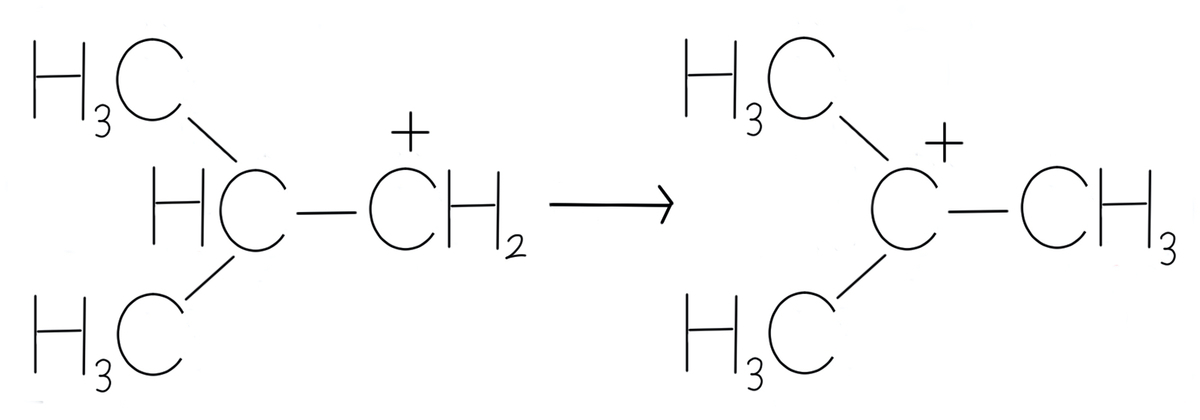
次に、3番のカルボカチオンについて考えましょう。
aと記した水素原子が、bと記したところに移動していますね。

結論から言うと、そもそも3番は共鳴構造式ではありません。
前回の記事で勉強したとおり、共鳴構造式は極限構造式を両矢印で関連付けて、真の構造を表現する式でしたよね。
その際、動いているのは電子のみでした。
今一度、酢酸イオンの共鳴構造式を示します。

3番の式は、電子以外のもの、つまり、水素の元素記号Hが(aのところからbのところに)動いてしまっていますよね。
これは共鳴構造式ではなく化学反応を表しています。
2つの構造を両矢印でつなぐのではなく通常の矢印(片矢印)でつなぎます。
共鳴は分子やイオンが変化する(化学)反応ではなく、現象とか状態と言った方が適切です。
電子のみ動いているのが共鳴構造式です。
このことが共鳴構造式なのかどうかを見分けるポイントです。
ぜひ2番の選択肢も見返してみてください。
電子のみが動いていて、炭素や酸素、水素(の元素記号)は動いていません。
というわけで、共鳴構造式として誤っている3番が正解です。
それでは、4番と5番も確認していきましょう。
4番はジアゾメタンという化合物です。
そもそも構造が複雑なので、形式電荷が合っているのかどうか、分かりづらいですね。
ルイス構造式に書き直し、確認しておきましょう。
共鳴構造式とともに、線で書いてある結合を電子(●)に直したルイス構造式を下に示しました。

炭素は原子番号が6番なので、その電子は1s軌道に2コ、2s軌道に2コ、2p軌道に2コ入っており、結合形成に使われる可能性のある電子は1s軌道の電子を除いた4コです。

それでは、炭素原子上の形式電荷が合っているのかを確認していきましょう。
各々の原子同士でシェアしている電子を半々にして数えていきます。

左側のルイス構造式の炭素原子に属する電子は5コなので、元々の価電子よりも1コ多くなっており、マイナスで合っています。
一方で、右側のルイス構造式の炭素原子に属する電子は4コです。
元々の価電子と同じなので形式電荷は0であり、プラスもマイナスも書きません。
形式電荷の確認の仕方が分からなくなったら、私の形式電荷に関する記事で復習していただければと思います。
chemist-programming.hatenablog.jp
続いて、窒素原子上の形式電荷について考えていきます。
窒素の原子番号は7番ですね。
もともとの窒素原子がもつ電子は、1s軌道に2コ、2s軌道に2コ、2p軌道に3コ入っています。
下図のとおり価電子は5コです。

先ほどと同様にして、窒素原子の形式電荷について考えていきましょう。
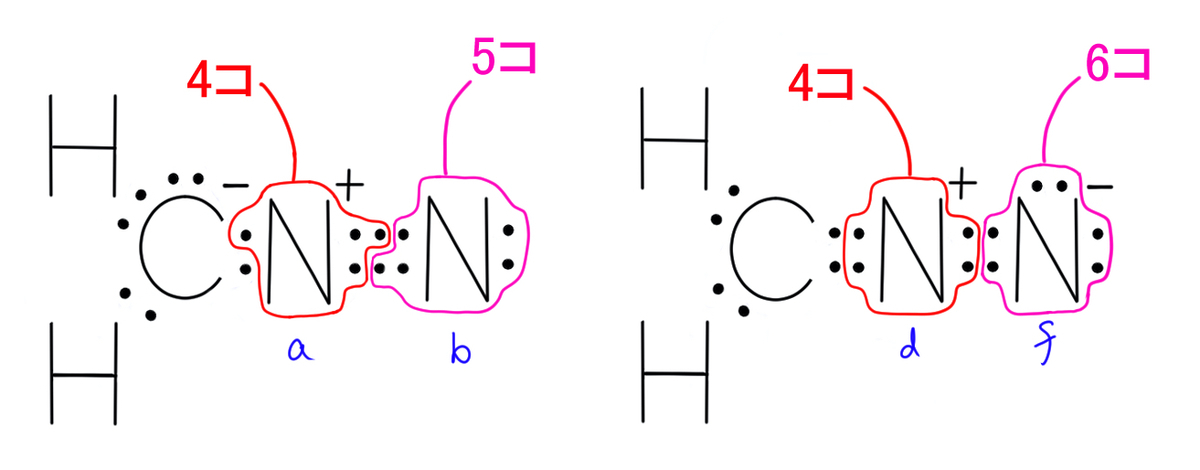
窒素原子aに属する電子は4コなので元々の価電子よりも1コ少なくなっており、プラスの形式電荷で合っています。
窒素原子bに属する電子は5コなので形式電荷は書きません。
窒素原子dに属する電子は4コなのでプラス、窒素原子fは6コなのでマイナスで間違いはありません。
複雑な構造でしたが、形式電荷に間違いはありませんでしたね。
ちなみに、共鳴構造式の詳細を示す巻矢印は下のように書きます。

非共有電子対と、線で書かれた結合を動かし、左側から右側へ、そして右側から左側へ電子が動く様子を書くことができます。
というわけで、4番の共鳴構造式に間違いはありませんでした。
はい、最後の5番はエノラートですね。
アセトンが脱プロトン化されて生じるエノラートです。
選択肢の共鳴構造式に非共有電子対と巻矢印を書き足すと、次のようになります。

この選択肢も間違いはありません。
4番と5番の共鳴構造式も、やはり各々の元素記号は動かずに電子のみが動いていますよね。
一応、4番と5番の非共有電子対を省略して巻矢印だけ書いた形を次に示しておきますので、ご確認ください。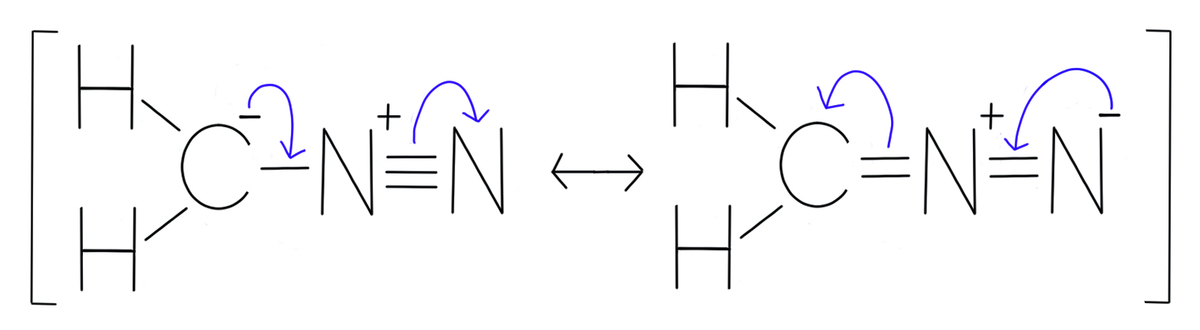

先ほど述べたように、こちらの方が一般的によく見られる形です。
しかしながら、これも繰り返しになりますが、始めのうちは非共有電子対を省略しないで書くようにした方が正しく理解できると思います。
以上、共鳴構造式のミニ講義を2回に分けて記事にしました。
共鳴構造式に関連した過去の記事のリンクを貼っておきますので、合わせてご覧いただければと思います。
chemist-programming.hatenablog.jp
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ
(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000117691.html)