【薬剤師国家試験 第102回 問108】NMRはシンプルなピークから解析していこう


問108は、NMRの問題です。
NMRの問題は、第103回の問107で行なったように、個人的にはシンプルなピークから解析していくのがベターだと思います。*1
それでは、シンプルなピークから、どのような官能基があるのか判断し、5つある選択肢を絞っていきましょう。
まずは、もっともシンプルなピークである一重線から確認していきましょう。
チャートを眺めてみると、2.3 ppmぐらいのところに3H分の一重線がありますね。
1.7–2.5 ppmぐらいの範囲にある3H分の一重線は、たいていアセチル基(–COCH3)
のCH3のHか、ベンゼン環に直接結合したメチル基のHのピークでしょう(Ph–CH3)。
選択肢の中にアセチル基をもつ化合物はないので、ベンゼン環に直接結合したメチル基をもつ1、4、5の選択肢に正解を絞ることができます。
ただし、5の化合物は、ベンゼン環に直接結合したメチル基が3つもあるので、正解ではないようです。
ちなみに、2と3の化合物がもつ「メトキシ基(-OCH3)」のHは、3.0–3.9 ppmぐらいの範囲に3H分の一重線として検出されます。
以上のことから、正解が1か4に絞られました。
それでは、再びチャート上のピークを見ていきましょう。
先に述べたとおり、シンプルなピークから優先的に確認していきます。
メチル基のHの次にシンプルなピークは、どのピークでしょうか?
アの6H分のピークが二重線なので、分かりやすそうですね。
1と4の化合物の構造をよく見てみると、6H分の二重線になるピークは、イソプロピル基のメチル基のHであることが分かります。
下に、その詳細を示しました。

あるプロトンの隣にあるHの数が1個のとき、そのプロトンのピークは2個に割れるんでしたね。
隣にHがn個あるとき、ピークはn+1個に割れることを思い出しましょう。
一方、メチル基の間に挟まれたメチン水素は、1H分の七重線になります。
両隣のメチル基を合わせて、プロトンが6個ありますからね。
チャートを見てみると、ウのピークが、イソプロピル基のメチン水素のピークに相当することが分かります(1H分の七重線)。
以上のことから、正解の化合物は明らかにイソプロピル基を持っていますね。
というわけで、正解は1の化合物で決定です。
ちなみに今回、アセチル基とベンゼン環に直接結合したメチル基、そして、メトキシ基のHのピークがどの範囲に検出されるのか、その指標を示しましたが、絶対にこの範囲に検出されるというわけではありません。
例えば、第104回の問108で見られたように、置換基の周辺の環境によってピークの位置がシフトすることがあります。 *2
NMRの問題を解くときは、このことを留意して解きましょう。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問107】アダマンタン骨格の特徴を理解しよう

【1】……「ピペリジン」の構造は、シクロヘキサン(6員環)の炭素原子の一つが窒素原子になっているものでした。
ビルダグリプチンの右側の構造は5員環ですので、「ピペリジン」ではなく、「ピロリジン」です。

この2つの構造はよく出てきますので、必ず覚えておきましょう。
というわけで、【1】の選択肢は×です。
【2】……波線内の構造は、アダマンタンと呼ばれている有名な構造です。
下記の化合物が「アダマンタン」です。

下の4つの図は、アダマンタンに含まれている、各々のシクロヘキサン環に色を付けたものです。
ご覧のとおり、4つのシクロヘキサン環が隠れています。
これらのシクロヘキサン環は、すべて「いす形配座」です。
左の2つは分かりやすいと思いますが、右の2つは分かりづらいので、分子模型を組み立てて確認することをお勧めします。

すべて「いす形配座」ですので、対称構造をもちます(これも分子模型を組み立ててみるとよく分かります)。
この問題では、このことがポイントになります。
すべて「いす型配座」ですので、【2】の選択肢は○です。
なお、フリーソフトを使い、3次元でアダマンタンを示した動画をyoutubeにアップしていますので、興味のある方は是非ご覧になって下さい↓
【3】……aとbの窒素原子の塩基性を比べる問題です。
アミド構造の窒素原子(b)の非共有電子対は、下記の共鳴構造式が示すとおり、隣接するカルボニル基に引っ張られて非局在化しているため、プロトン化され難いです。

そのため、aの窒素原子の方が塩基性が強いです。
よって、【3】の選択肢は×です。
【4】……cの炭素原子の絶対立体配置について聞かれています。
一番優先順位の低い水素原子が手前側を向いているので、構造を裏返して考えましょう。

一番優先順位の高いのは、窒素が直接結合している部分です。
残りの2つは、ともに炭素原子が直接結合していますが、シアノ基は炭素原子に窒素原子が直接結合しているので、2番目に優先順位が高くなります。
1→2→3と辿っていくと、反時計回りになりますので、この不斉炭素原子の絶対立体配置は「S」です。
したがって、この選択肢の記述は間違いです。
【5】……非常に難しい設問ですね。
問題になっている炭素原子dとeの周辺を、【2】で示したアダマンタンの書き方に習って書き直しました。
eの炭素原子に水酸基が1つ置換しており、dの炭素原子には残りの構造が続いていますが。
アダマンタンの対称性が崩れているようにも見えますが、下記のピンク色で囲った部分は同じものです。

図の真ん中に対称面があるので(←人体に置き換えるなら正中面のところです)、その面の左側の構造と右側の構造は同じものになります。
それら左右の構造は面対称の関係にあるわけです。
そのため、対称面上にあるdとeの炭素原子は、キラル中心ではありません。
【5】の選択肢は、×です。
ぜひ、分子模型を組み立てて確認してみてください。
以上のことから、正しい記述は【2】と【5】でした。
アダマンタンの化学は難しいですよね。
しつこいようですが、模型を組んでみないとイメージができないかもしれません。
ただし、この問題はアダマンタン骨格とは関係ない【1】、【3】、【4】の選択肢が明らかに×なので、正解することはさほど困難ではないでしょう。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問106】ペプチドの構造を見極めよう

ペプチド系の医薬品に関する問題ですね。
それでは早速、選択肢を見ていきましょう。
【1】……一般的にN末端は、ペプチドを問題の図のように書いたとき、左端のことを指しますよね。
アミノ酸がD体であるのかL体であるのか、その見分け方を復習しましょう。
活性成分Aの左端の構造を下に示しました。
この構造を、Fischer投影式に書き直します。

まず、カルボン酸の部分を上側にして、側鎖の部分を下側にします。
この時、カルボン酸の部分と、側鎖の部分は向こう側を向くようにします。
すると、窒素の部分と水素原子は、おのずと手前側を向くことになりますよね。
このとき、窒素の部分が左側にあるとL体、右側にあるとD体になります。
設問には「D-プロリン」と書かれていましたが、この構造は窒素の部分が左側にあるのでL体であることが分かります。
しかも、よく見てみると、この構造はプロリンの構造ではありません。
窒素原子の隣(α位)がカルボニル基になっていますよね。
正しいプロリンの構造を、下に示しておきます。
ご覧のように、アミノ基の部分はピロリジン環になっています。

以上のことから、【1】の選択肢は×です。
【2】……C末端は、N末端の反対側、つまり右端のことですよね。
設問に書いてある「窒素」は、下図の赤い矢印で示したNのことを指しています。

このNは、本当にプロリンの環内にある窒素原子なのでしょうか?
プロリンの窒素原子は、N末端側の方向、つまり左側にあるはずなのに、右側にあるのはおかしいです。
一旦、この周辺の構造をしっかり書いてみましょう。

左方向がN末端側で、右方向がC末端側ですので、プロリンの窒素原子を左側に、カルボキシル基の炭素原子を右側に書きました(赤い円で囲っています)。
問題の図と比較してみると、プロリンのカルボニル基がアミド構造になっており、さらにN-エチル化されているということが分かります。
このことから、設問の「窒素」は、環内の窒素ではないことが分かりました。
【2】の選択肢も×です。
以上のように、記号で省略されているアミノ酸の構造をしっかり書き出してみると分かりやすくなると思います。
【3】……確かに、ペプチド鎖の真ん中のあたりに「D-」の文字があります。
「D-Leu」は「D-ロイシン」のことですので、この記述は○です。
【4】……ペプチド系の医薬品ですので、経口投与したら胃や膵液、小腸の酵素「ペプチダーゼ」で分解されやすいですよね。
みなさんご存知の通り、タンパク質は酵素で分解されてから、小腸で吸収されます。
この記述は○です。
以上のことから、【3】と【4】が正解でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問105】変化している部分構造に着目しよう

体内では、グアニンが加水分解されることによってキサンチンに変換された後、酸化されて尿酸が生成するそうです。
この問題では、途中で生じるキサンチンの構造を考えます。
最終的に尿酸に変換されるためには、図の位置a, bのどちらかに、酸素原子が導入されなければなりません。

問題文には、最初の段階で「加水分解」と書かれていますので、aまたはbの位置で加水分解してみましょう。
H2Oに由来する酸素原子が導入されて、キサンチンが生じることが予想されますよね。
加水分解して考えていきたいのですが、その前に、この反応条件はどのぐらいのpHを想定したら良いのかを考えましょう。
胃液や膵液など、生体内にpHが酸性や塩基性の環境はもちろんありますが、基本的には中性です。
とりあえず、ここでは中性の条件で加水分解して考えていきますね。
まずはaの位置で加水分解してみます。

この反応機構は難しいのですが、共鳴構造式(A ↔︎ B)を書いて極限構造式Bで考えると、分かりやすいと思います。
aの位置に水分子が付加し、プロトンの移動を経て、化合物Cができあがりました。
赤線で囲った部分構造は、選択肢の構造の中にはありませんでした。
また、反応機構をCから先に書き進めてみても、五員環の部分が分解してしまいます。
五員環の部分が分解してしまった構造も、選択肢にはありません。
なお、この反応機構についてですが、共鳴構造式(A ↔︎ B)を書かずに、AからCへの変換を下記のように書いても良いと思います。

続いて、bの位置で加水分解してみましょう。

こちらの場合も、共鳴構造式(A ↔︎ D)を書いて極限構造式Dで考えると、やはり分かりやすいと思います。
bの位置に水分子が付加し、プロトンの移動を経た後、アンモニアが脱離します。
その結果、選択肢2番の化合物になりました。
もちろん、これも共鳴構造式(A ↔︎ D)を書かずに、下記に示すようにAから2番の化合物への変換を書いても良いと思います。

以上のように、aではなくbの位置で加水分解すると、キサンチンの構造にたどり着くことができました。
正解は2番になります。
この加水分解について調べてみると、実際のところは生体内の酵素によって引き起こされる反応でした。
酵素反応とはいえ、今回述べたように、有機化学で学習した加水分解の反応機構を実際にとりあえず書いてみるだけでも、答えを導くことが可能です。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問104】フリーデル・クラフツ アルキル化 〜解法はニ通りある〜

化合物Aを塩化アルミニウムと反応させて化合物Bを合成し、水酸化ナトリウムを用いる条件でジクロフェナクナトリウムに変換しています。
第一段階のAlCl3で思い出される反応は、Friedel–Craftsアルキル化ではないでしょうか?
下記のような反応でしたね。
ハロゲン化アルキルのハロゲン部分が塩化アルミニウムと反応した後、芳香族求電子置換反応を起こします。
この時、ハロゲン化アルキルの構造によっては、もちろんカルボカチオン中間体が生成することもありますし、その際、水素やアルキル基が移動して転位することもあるんでしたね。
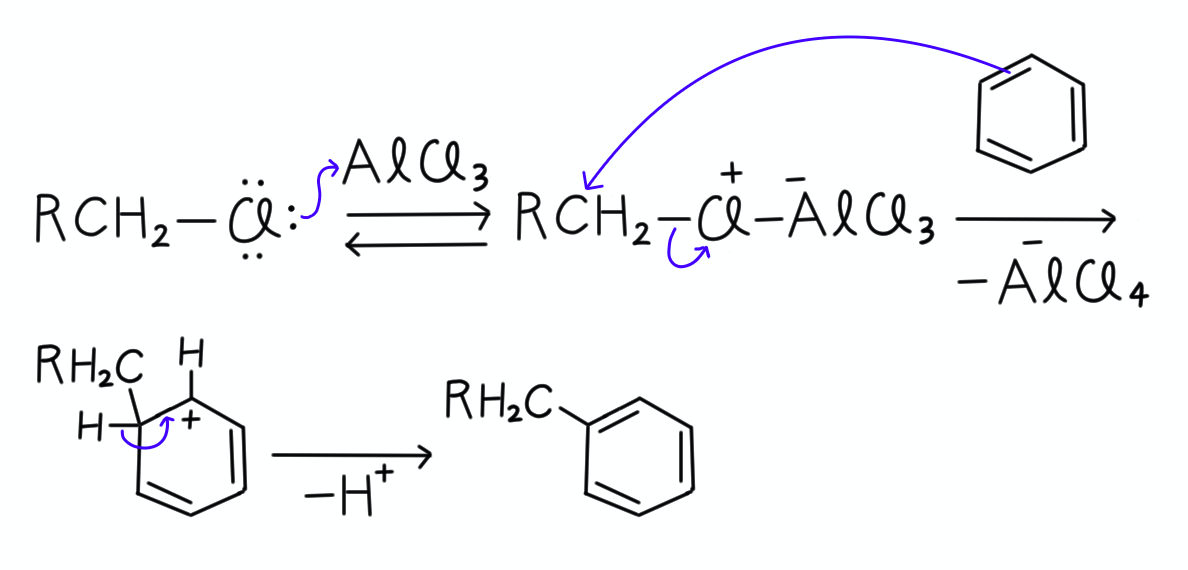
Friedel–Craftsアルキル化を、問題になっているAの反応に当てはめると、次のようになります。
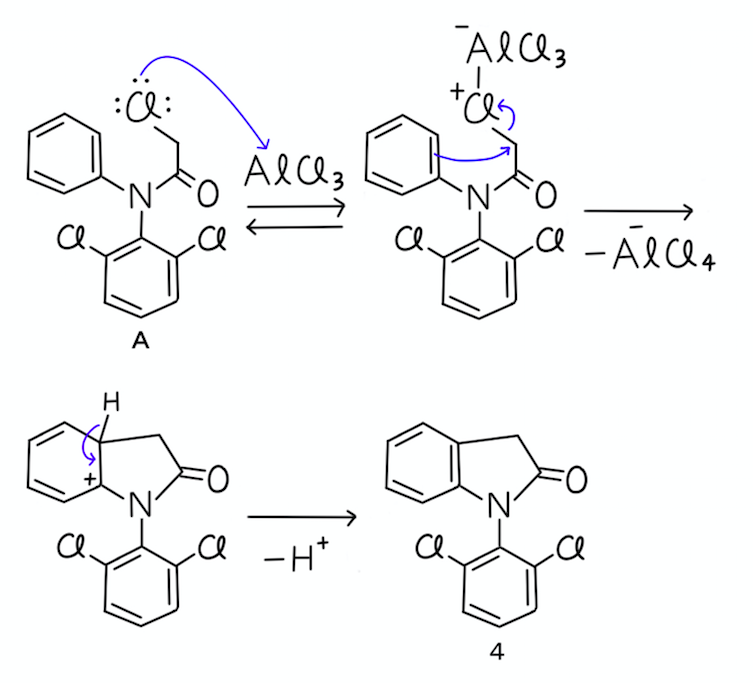
ハロゲン部分が塩化アルミニウムと反応した後、分子内の芳香族求電子置換反応を起こします。
最終生成物は、選択肢4番の化合物になります。
さて、この問題の反応式を見てFriedel–Craftsアルキル化を思いつくのは、なかなか難しいと思います。
思いつかなかったり、そもそもFriedel–Craftsアルキル化を忘れてしまったりした場合でも、解法がもう一つあります。
どういうことかと言いますと、最終生成物であるジクロフェナクナトリウムから逆算して考える……という方法があります。
つまり、NaOHと反応してジクロフェナクナトリウムになる化合物はどれなのか? ……と考えればいいわけです。
候補となる選択肢1から5の化合物を上記の反応条件に付してジクロフェナクナトリウムに変換されるのは、4番の化合物だけですよね。
下に示すように、アミド構造が分解してジクロフェナクナトリウムになります。

ちなみに余談ですが、エタノールは4番の化合物を溶かすために使われていると思われます。
このエタノールと水酸化ナトリウムから、フラスコ内ではナトリウムエトキシドが発生していることになります。
そのため、ナトリウムエトキシドがアミド構造を分解させて、エステルが生じている可能性があります。
ただ、このエステルはさらに水酸化ナトリウムと反応して、最終的にはジクロフェナクナトリウムに変換されるでしょう。

---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問103】LAH還元の反応機構を書こう

水素化アルミニウムリチウム(LAH、LiAlH4)を用いたカルボン酸の還元ですね。
この反応の大まかな流れは、次のようになります。

カルボン酸からアルデヒドに還元された後、そのアルデヒドがさらに還元されます。
反応はAのリチウムアルコキシドでストップします。
上記のスキームから、aおよびbのHは、水素化アルミニウムリチウムに由来すのであることが分かりますね。
続いて、生じたリチウムアルコキシドをH3O+(またはH2O)で処理することにより、最終生成物のアルコールが得られます。
水酸基のHは、H3O+(オキソニウムイオン)由来というわけです。

以上のことから、aとbのHが水素化アルミニウムリチウム由来で、cのHだけオキソニウムイオン由来であることが分かります。
というわけで、正解は3番の選択肢でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)
【薬剤師国家試験 第102回 問102】オゾン分解による結合の切断パターンを思い出そう

オレフィンに対してオゾン(O3)を作用させて、ジメチルスルフィド((CH3)2S)や、亜鉛(Zn)などの還元剤で処理すると、炭素と炭素の二重結合が切断されます。
最後は、還元剤((CH3)2SやZn)で処理します。
この反応は、いわゆる「オゾン分解」ですよね。
この反応機構は難しいのですが、下に示しておきますね。

まず、オゾンとオレフィンが反応して、五員環をもつ中間体Aができます。
この中間体Aは分解して、結合の組み替えが起こります。
こうして、Aとは異なる新たな五員環をもつ中間体Bが生じた後、還元剤によって再び分解されて、カルボニル基を2個もつ化合物Cができます。
この主生成物Cは、選択肢の5番の化合物ですよね。
ちなみに、還元剤であるジメチルスルフィドは、酸化されてジメチルスルホキシド(DMSO)に変換されています。
反応機構はかなり難しかったのですが、オゾン分解の特徴が分かっていれば、反応機構が分からなくても、反応物を見るだけで正解を導けます。

結果的には、単純に二重結合が切断されて、その切り口が両方ともカルボニル基になっているだけですよね。
落ち着いて、炭素原子の数やカルボニル基の位置などを、選択肢の構造式と照らし合わせれば正解にたどり着けます。
というわけで、正解は5番でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000168886.html)