続いて、第104回の問7を解いていきましょう。
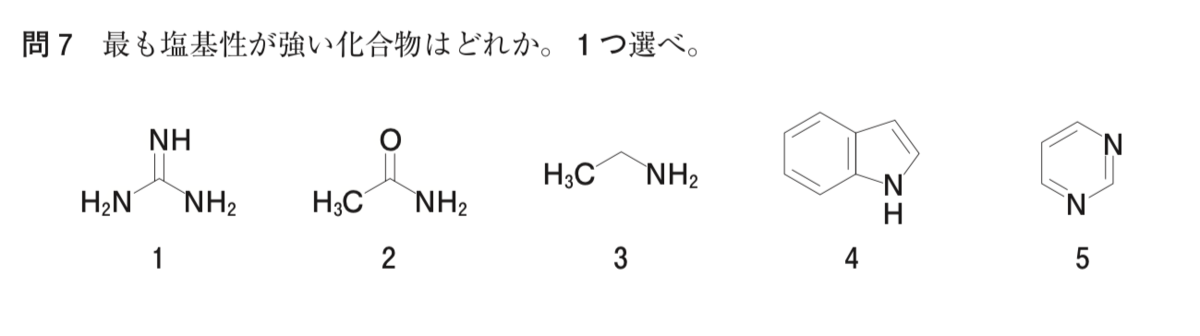
塩基性の強さを比較する問題ですね。
1の化合物はグアニジンであり、塩基性を示します。
塩基性の強さを評価するときは、評価する化合物をプロトン化してみると理解しやすくなります。
その様子を下に示しました。
赤い矢印で示した位置の窒素原子がプロトン化されると、共鳴構造式を書くことができますよね。
共鳴構造式が書けるということは、共役酸が安定化されているということです。
そのため、グアニジンは強い塩基性を示します。

2の化合物はアミド構造をもっていますね。
アミド構造をもつ化合物は、他に特徴的な官能基をもっていなければ、基本的に中性と考えていいでしょう。
アミド構造における窒素原子の非共有電子対は、隣接するカルボニル基に引っ張られているのでプロトン化を受けづらいのです。

3の化合物は第1級アミンであり、もちろん塩基性を示します。
ただし、その強さは、プロトン化されると共鳴安定化を受ける1のグアニジンには及びません。
4の化合物は芳香族性をもつ化合物、インドールです。
窒素原子がもつ非共有電子対は、下の共鳴構造式が示すように、環上に非局在化しています。

さて、インドールが芳香族性を示すかどうか確認するために、環上にπ電子がいくつあるのか数えてみましょう。*1
ベンゼン環のp軌道を占める電子(6π)と、窒素原子の右隣にある二重結合のp軌道を占める電子(2π)、そして窒素原子の非共有電子対(2π)を合わせて、10πになります。
これらのπ電子が非局在化することにより、芳香族性を示している(=安定化している)ため、インドールへのプロトン化は極めて起こりづらいでしょう。
最後の選択肢である5は、DNAやRNAの塩基に含まれている大切な化合物、ピリミジンですよね。
ピリミジンの構造中には、図に示したようにp軌道を占める電子が6つ存在し、芳香族性を示すための電子がそろっています。

そのため、窒素原子の非共有電子対は選択肢4のときのように共役することはありません。
下図のように、ピリミジンの非共有電子対はsp2軌道に入っており、塩基性を示します。

さて、ここで、このピリミジンの塩基性の強さを3のアミンと比較してみましょう。
3のアミンについては、窒素原子の非共有電子対がsp3軌道に入っていますよね。

sp2軌道はsp3軌道よりもs性が高いため、占有している非共有電子対が、より原子核の方に引きつけられているんでしたよね。
したがって、ピリミジンの非共有電子対は、3のものよりもプロトン化されづらくなっています(=塩基性が弱い)。
ただし、これら2つの化合物よりも、共役酸の共鳴構造式が書けるグアニジンが選択肢の中で最も塩基性が強いです。
というわけで、正解は1番です。
<s性の復習>
sp軌道……s性が50%
sp2軌道……s性が33%
sp3軌道……s性が25%
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
*1:「π電子」とはπ結合をつくっている電子のことであり、p軌道に入っています。二重結合のうち、弱い方の結合を形成している電子のことです。