【薬剤師国家試験 第104回 問105】ニトロソニウムイオンの問題は反応機構を思い出しながら解こう
続いて、問105を解いていきましょう。

亜硝酸ナトリウムとHClから発生するのはニトロソニウムイオンです。
反応機構を書けるようにしておきましょう。

【3】のアニリンと反応した場合、塩化ベンゼンジアゾニウムが生成しますよね。
高校化学でもおなじみの、ジアゾ化です。

したがって、【3】の生成物は間違いです。
ちなみに、この反応は温度を低くしていないとダメです(5 °C以下)。
冷やしていないと、H2Oと反応してフェノールになってしまいます(たいてい、水存在下で反応を行ないます)。

さて、この問題は、ニトロソニウムイオンが反応するため、基本的にニトロソ基(–NO)が導入されるわけです。
そのため、ニトロ基(–NO2)が導入されているものは全部×ですよね。
【1】と【4】は×です。
【2】……第2級アミンをニトロソ化すると、どうなるのでしょうか?
ニトロソニウムイオンが反応したのち、さらにOがプロトン化されても、脱プロトン化できません(メチルカチオンは不安定なので生成しづらいです)。
そのため、ジアゾ化のときと異なり、この段階で反応が止まります。
【2】の生成物は正しいですね。

【5】……これまでの選択肢とは異なり、芳香環上で反応が起こっています。
第3級アミンの場合、ニトロソニウムイオンがアミンの窒素原子上で反応しても、反応機構を書き進めることができません。

そのため、ニトロソ基はベンゼン環と反応したんだな……ということが分かります。
いわゆる、芳香族求電子置換反応です。
反応した位置は、ジメチルアミノ基に対してp-位ですね。
ジメチルアミノ基は、下に示したとおり電子供与性基です。
共鳴構造式が示すように、反応性が高い位置はo-位とp-位ですね。
【5】の生成物はp-位がニトロソ化されているので、正しいです。

というわけで、正解は【2】と【5】でした。
アミンの構造によって生成物が大きく異なることを理解しているかどうかが、ポイントでしたね。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問104】活性メチレンと求核置換反応の化学を駆使して解こう
この問題では、活性メチレンについて、そして求核置換反応について学べます。
これらについて、しっかりと復習しましょう!

下記のように、活性メチレン部位のHを塩基であるナトリウムエトキシドが引き抜き、エノラートが生成します。
生じたエノラートはハロゲン化アルキルなどの求電子剤と反応します。
この段階は、いわゆるSN2反応ですよね。
反応機構を下に示しました。
反応相手は、臭化メチル(ブロモメタン)です。

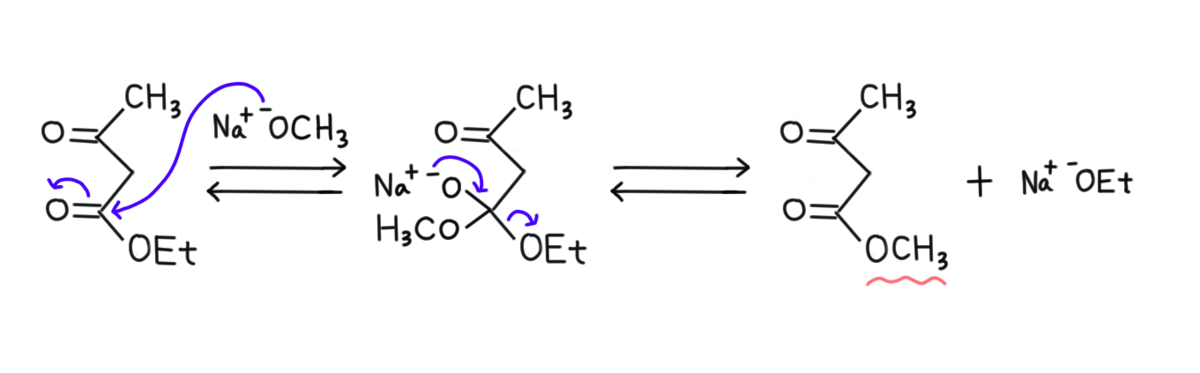
ちなみに、このときにナトリウムエトキシドを使っているのには理由があります。
他のアルコキシドを使ってしまうと、下に示したようにエステル交換が起こってしまうためです(下の例はナトリウムメトキシド)。
それでは、選択肢の求電子剤を1つずつ見ていきましょう。
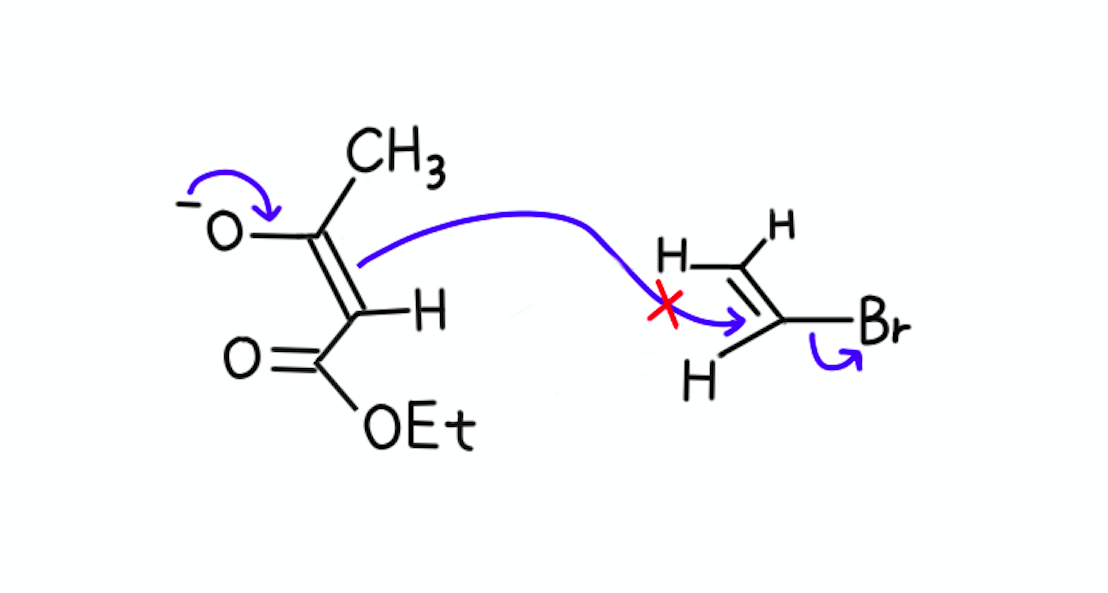
【1】……これはハロゲン化アリールですね。
ベンゼン環にハロゲンが直接置換している化合物が、SN2反応の求電子剤になることは、まずあり得ません。
SN2反応では脱離基の背面から求核剤が近づいてきますよね。
混み合っているC=C結合の平面内に接近しなければならないため、反応性に乏しいと考えられています。

【2】……これも【1】の化合物と同様の理由で、反応し難いです。
C=Cの構造にハロゲンが直接結合していたら、SN2反応に不活性です。
【3】……ベンジルブロミド(= ベンジルブロマイド = 臭化ベンジル)は、反応する位置がベンジル位になります。
ベンジル位やアリル位は反応性が高いので、この選択肢は正解候補ですね。
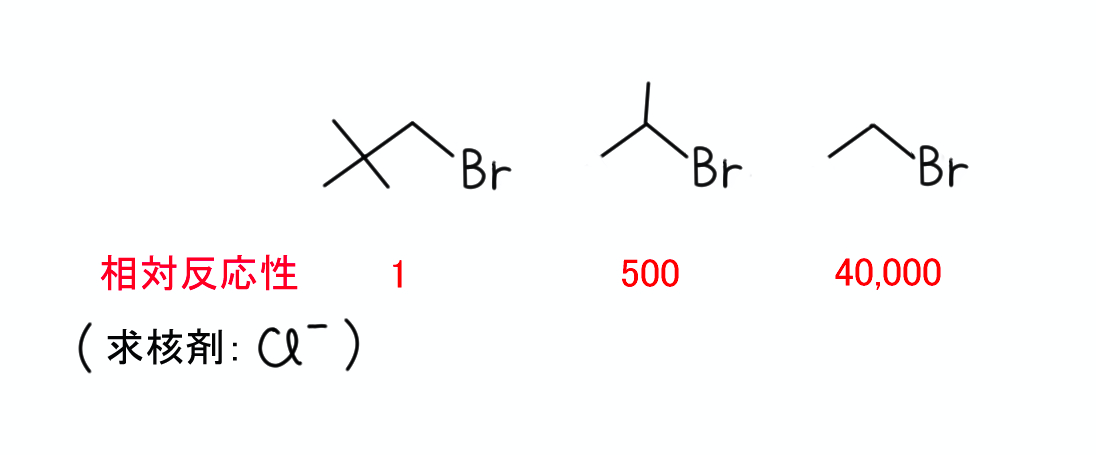
【4】……SN2反応において、第3級のハロゲン化アルキルは立体障害が大きいため、反応し難いです。
【5】……この化合物は立体障害の大きいtert-Bu基が置換していますが、第1級のハロゲン化アルキルなので反応が進行しないということはなさそうです。
ただ、【3】のベンジルブロミドと比較すると、その反応の進行は遥かに遅いでしょう。
ちなみに、この化合物は第1級のハロゲン化アルキルですが、立体障害の大きいtert-Bu基が置換していますので、反応性は第2級よりも遅いことが知られています。*1
以上のことから、正解は【3】です。
この問題で出てきたSN2反応のポイントをまとめでおきますね。
・ハロゲン化アルキルの反応性は、第1級 > 第2級 > 第3級
・ベンジル位やアリル位における反応性は高い
・ハロゲン化アリールやハロゲン化アルケニルは反応が起こりそうもない
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問103】反応する官能基を見抜こう
続いて、問103を解いていきましょう。

この反応は、ケトンとヒドラジン誘導体の反応ですね。
大学の講義では、「シッフ塩基」とか「カルボニル試薬」という言葉を用いた説明があったかもしれません。
まずは、各々の化合物のどの官能基が反応に関わるのかを見極めましょう。
d-カンフルの構造中で反応性が高い官能基は、カルボニル基ですよね。
反応相手が求核性をもつのであれば、カルボニル基は求電子剤になります(条件次第ではエノールやエノラートになり、求核性をもつ化合物になります)。
一方、2,4-ジニトロフェニルヒドラジンは、ヒドラジン部分(アミノ基)が求核性をもちます。
ニトロ基はあまり反応性が高くないですよね。
比較的強力な還元剤を使用した場合に反応します。
この反応では、2,4-ジニトロフェニルヒドラジンが求核剤になり、d-カンフルが求電子剤になるわけです。
それでは、実際に反応機構を書いてみましょう。
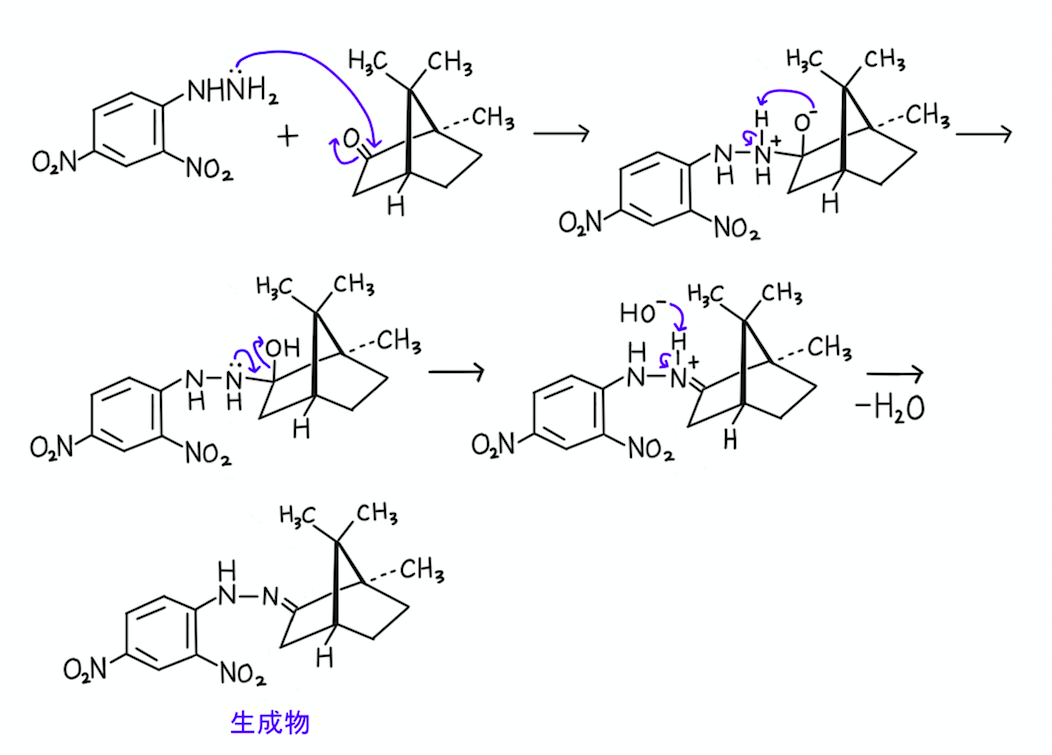
【1】……脱水縮合ということは、2つの化合物が結びつくとともに、水分子が生成するわけですよね。
その通りなので、この記述は◯です。
【2】……窒素は発生しませんよね。
窒素原子が2つあるので、窒素が発生するだろう……と思わせる引っ掛けでしょう。
反応機構を書くことができれば、間違えませんよね。
この選択肢は×です。
【3】……オキシムは下記の構造をもつ化合物のことでしたよね。
主に、Beckmann転位を学ぶ際に登場します。
この選択肢も×です。

【4】……オレフィン構造はもちません。
反応機構を書くことができれば、このような選択肢には惑わされませんね。
【5】……生成物の構造の中には、ベンゼン環を含む共役系が確かに存在していますね。
このような化合物は、たいてい色をもちます。

ちなみに、この反応は呈色に使われます。
実際に、有機合成の現場で使われるんですよ。
TLCのスポットから、カルボニル基があるのかどうかすぐに判断できますので、重宝されます。
たしかにスポットが橙赤色になります(黄色っぽいときもあったような気がしますが)。
以上のことから、【1】と【5】が正解です。
反応機構を書くことができれば、わりと簡単に解けますね。
反応機構を書く時間がなかったり、そもそも反応機構を覚えていなかったりしたら、どの官能基とどの官能基が反応するのかだけでも見極めましょう。
先述のとおり、カルボニル基とヒドラジン部分(アミノ基)が反応します。
それさえ分かれば、C–NもしくはC=N結合ができることが分かります。
そのため、ヒドラジン部分のNを2つとも失ってしまう【2】、そして、生成する結合がC=Cである【4】を選ぶことはなく、正解できる確率を上げられますね。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問102】生化学反応の反応形式を見極めよう
問102は生体内での反応の、反応形式を判別する問題です。
求核置換反応(SN反応)に分類される反応を選ぶわけですね。
SN反応という用語は、SN1反応とSN2反応のことを意味しているのだと思います。*1
それでは、SN1反応とSN2反応を選んでいきましょう!

 【1】……反応物の構造がどのように変化しているのか、よく見てみましょう。
【1】……反応物の構造がどのように変化しているのか、よく見てみましょう。
ピロリン酸(のイオン)の部分が水酸基に置き換わっていますよね。

ピロリン酸(のイオン)の脱離と水の求核攻撃が起こったわけですね。
求核攻撃と置換基の脱離が起っているので、この反応は求核置換反応です。
アリル位の炭素原子上で反応が起こっているので、SN1反応だろうとSN2反応だろうと有利ですしね。
なお、私にはこの反応がSN1反応なのかSN2反応なのかを断定することが困難です。
水は求核剤としてはあまり優れていないことから、下に示したようにSN1反応が妥当だとは思いますが……。

【2】……なかなか複雑な構造ですが、変化している箇所を見極めましょう。

図で示したメチル基が、もう一方の化合物の窒素原子に移っていますね。
メチル基の炭素原子に向かって窒素原子が求核攻撃したことになります。
そして、硫黄を含む化合物が脱離したというわけですね。
求核攻撃と脱離が起こっているので、求核置換反応ですね。
この反応は下に示したように、SN2反応でしょう。

SN1反応だとしたら、メチルカチオン(とても不安定)が発生していることになりますからね。

【3】……これまでの設問と同様に、 変化しているところを探しましょう。

脱プロトン化したカルボキシル基(カルボキシラートイオン)の部分が、二酸化炭素になって外れていますね。
二酸化炭素が生じる反応といえばα位にカルボニル基をもつカルボン酸の「脱炭酸」ですよね。
反応機構を書いておきます。
脱炭酸を起こす際には分子型のカルボン酸になっていることが必要です。
まずは、プロトン化させて分子型にしましょう。
続いて、下の段に移ります。
六角形を描くようにカルボン酸の向きを変えることがポイントです。
脱炭酸は一段階の反応ですので、巻き矢印を一気に書きましょう。
ちなみに、この問題は生体内の反応を表しているようですが、フラスコ内での合成実験では、通常、この段階で加熱が必要です。

脱炭酸は、SN1反応でもSN2反応でもありません。
【4】……またしても複雑な構造です。
ただし、変化している箇所を探してみると、ほんの一部分ですよね。

水酸基(–OH)がなくなって、アルケンに変換されています。
赤い矢印で示したHも一緒になくなっていますね。
どのようなメカニズムを経て生体内で反応が進行しているかは不明ですが、H2Oがなくなっているので「脱水反応」です。
求核置換反応ではありません。
【5】……1つの化合物が2つの化合物に分解していますね。
このような場合は、まず、どの結合が切断されているかを見極めましょう。
下図の赤い波線で示したところの結合が切断されていますね。

問題文に示されている分解物が生じるように巻き矢印を書いてみると、次のようになります。

何が起こっているのかよく分からないかもしれませんが、2つの分解物をよく見てみると、切断された箇所はカルボニル基のα位の炭素原子とホルミル基の炭素原子であることに気づくと思います。
この組み合わせは、「アルドール反応」の反応物ですね。
2つの分解物を元の形に戻してみると、アルドール反応であることは明らかです。

元々の分解は、アルドール反応の逆反応(=逆アルドール反応)だったというわけです。
アルドール反応だろうと逆アルドール反応だろうと、求核置換反応ではありませんね。
以上のことから、正解は【1】と【2】でした。
難しい問題でしたね。
ただ、反応の詳細が分からなくとも、反応物と生成物のどこが、どういう形式の反応で変化しているのかさえ分かれば正解にたどり着くことができます。
変化している構造を探すところから始めましょう。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
*1:SNi反応という反応形式も含むのかもしれません。SNi反応が薬剤師国家試験に出題されたことはないと思いますが……。
【薬剤師国家試験 第104回 問101】六員環の化学を考慮しながらE2反応の問題を解こう
問101はE2反応と六員環(シクロヘキサン)の化学を組み合わせた問題ですね。
学ぶことが多い問題ですので、しっかりと復習しておきましょう。

問題文にE2反応と書いてあります。
強塩基であるナトリウムエトキシド(NaOC2H5)によって反応物のHが1つ引き抜かれ、それと同時に塩化物イオン(Cl–)が脱離したわけですね。
その結果、B と Cのアルケンが生成しています。
それでは、選択肢を上から読んでいきましょう。
【1】……化合物Aの立体配座に関する記述です。
Aの最も安定な配座について、考えていきましょう。
この化合物は、3つの置換基を備えたシクロヘキサンです。
まずは、最も嵩高い置換基であるイソプロピル基が、エカトリアルに配向している配座になるように図示します(①)。
置換基がアキシャルに配向していると、「1,3-ジアキシャル相互作用」により化合物が不安定化されてしまうんでしたよね。
エカトリアルに配向しているイソプロピル基を書いたら、それに対応して他の置換基も正しく書いていきましょう(②)。

この図は、IIの立体配座と同じですよね。
選択肢1は◯です。
【2】……E2反応においては、引き抜かれるHと脱離するクロロ基が、反対向きで同一平面上(アンチペリプラナー)のときに、最も反応が進行しやすいんでしたね。
言い換えると、水素原子とクロロ基がともにアンチの関係にあり、かつアキシャルに配向しているときに反応が進行します。
したがって、反応はIではなくIIの立体配座のときに進行しますね。
選択肢2の記述は×です。

【3】……BとCのどちらが多く生成するのかを聞いていますね。
設問2でIIの立体配座で反応が進行することが分かったので、この立体配座を考えていきましょう。
このとき、下に示したaとb、どちらのHも引き抜かれ得るHです。
クロロ基とアンチの関係にあり、かつ、同一平面上にありますからね。
aのHが反応すると化合物Bが生成し、bのHが反応すれば化合物Cが生成します。

E2反応では、生じるアルケンに着目しましょう。
アルケンの安定性は、以下の通りでしたよね。
多置換アルケンであるCが主生成物になるので、 選択肢3の記述も×です。

【4】……この反応はE2反応ですから、一段階で進行します。
カルボカチオン中間体は経由しませんので、この記述は間違いです。
この設問は、E1反応とE2反応を区別できていない人に向けた引っ掛けでしょう。
【5】……E2反応の反応速度は、下記の式で表されます。
v = k [R-X] [base]
E2反応の「2」は、反応速度vが2種類の化合物(ハロゲン化アルキルR-Xと塩基base)の濃度に比例することを意味しています(kは反応速度定数)。
以上のことから、正解は【1】と【5】です。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問100】キレートする部分構造を見極めよう
さて、ここからは理論問題に移りますね(有機化学に関連した問題に限定しています)。
早速、問100から始めていきます。
有名なキレート剤、EDTAに関する問題です。

【1】……十座配位子ということですが、そんなに多くの箇所で配位しないですよね。
カルボキシル基が4つに、窒素原子が2つあるので、配位し得る箇所は最大でも6箇所でしょう。
金属イオンに配位しやすい箇所は、マイナスに帯電している原子のところです。
もちろん、マイナスに帯電していなくても、非共有電子対をもっている原子なら配位することができます(O, N, Sなど)。
設問の十座配位子という記述は、カルボキシル基1つにつき酸素原子が2つ存在するので、合計10箇所(Oが8個、Nが2個)になる……という間違いを狙ったものでしょう。
ご存知の通り、カルボキシル基1つあたり1箇所で金属イオンに配位します。
1の記述は×です。
【2】……酸性条件下、そして塩基性条件下でEDTAはどのような構造になるのでしょうか?
下に、酸性条件下で全てプロトン化された場合と、塩基性条件下でプロトンが全て解離した場合のEDTAの構造を示しました。

カルボキシル基は、酸性条件下よりも、むしろ塩基性条件下でカルボキシラートイオンになった方が強く配位します。
反応条件によりますが、一般的にアニオンの状態になっている方が塩基性も求核性も高まりますよね。
アミン部位も、塩基性条件下の方が強く配位します。
酸性条件下ですと、アミン部位の窒素原子はプロトン化されてしまいますよね。
配位するために必要な非共有電子対がなくなってしまいます。
したがって、2の記述も×です。
【3】……最初に述べたとおり、EDTAはキレート剤ですよね。
金属イオンを挟み込むようにして(二座以上で)配位します。
もちろん、この記述は正しいです。
【4】……EDTAに蛍光特性はありません。
蛍光を発する化合物の特徴は、その構造中にπ電子の共役系がある(二重結合がつながっている)ことです。
有名な蛍光分子を下に示しました。

ご覧のとおり、π電子が共役していますよね。
以上のことから、この記述は間違いです。
【5】……設問1で述べたように、EDTAのOとNが金属イオンに配位します。
金属イオンに、カルボキシラートイオンの酸素原子と、近くにある窒素原子で配位している図を下に示しました。
たしかに5員環になりますね。
残りのOとNも同時に金属イオンに配位するため、EDTAは安定なキレート錯体を形成することが知られています。

以上のことから、【3】と【5】の記述が◯ですね。
この問100は……
☆ OとNが金属イオンに配位する。ただし、カルボキシル基は1つあたり1ヶ所で金属イオンに配位する。
☆ 蛍光特性がある化合物はどのようなものか分かっている。
……というポイントが分かっていれば解ける問題でしたね。
薬学生にとって錯体化学は勉強する機会が少ないので、難しい問題でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問9】ヒスタミンの生合成を思い出そう
問9は、 ヒスタミンに含まれる複素環を選ぶ問題です。
ヒスタミンの構造を覚えているならば難なく解けますが、覚えていないのであればアミノ酸や生合成の知識が必要です。

ヒスタミンは、生体内でアミノ酸のヒスチジンから生成するんでしたよね。
ヒトのタンパク質を構成するアミノ酸(20種類)の構造を全て書けるでしょうか?
ヒスチジンの構造を覚えていれば、5の選択肢が正解であることが分かりますよね。

ヒスタミンがヒスチジンから生合成されることを覚えていて、アミノ酸の構造を書くことができれば、解くことができますね。
他にも、生体内ではアミノ酸であるトリプトファンからセロトニンが、グルタミン酸からγ -アミノ酪酸(GABA)がつくられていますよね。

また、チロシンからドパミンやノルアドレナリン、アドレナリンがつくられていることも思い出しておきましょう。
あとは、尿素回路でアルギニンがオルニチンに変換されていますよね。
余談ではありますが、うんちの匂いは主にインドールとスカトールという化合物です。
腸内細菌がタンパク質を分解して生じるらしいので、トリプトファンに由来するのでしょうね。

ちなみに、インドールは濃度が高いと「うんちの匂い」、濃度が薄いと「ジャスミンの香り」がするそうです。*1
以上、おまけの雑学でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)