【薬剤師国家試験 第103回 問8】芳香族性を示すための条件を確認しよう
問8は芳香族性に関する問題です。

芳香族性を示すためには、「①環状に非局在化した π電子を4n+2個もつ」、かつ、「② その環が平面構造である」必要があります。
この2つの条件は、必ず覚えておきましょう。
まずは、「① 環状に非局在化した π電子を4n+2個もつ」という条件を満たすかどうか、確認していきますね。

π電子数を数えてみると、1(シクロペンタジエニルカチオン)だけが4個ですよね。
2(ピロール)や3(フラン)のπ電子数は、共鳴構造式を書いて確認しましょう。
NやOの非共有電子対は、環上に非局在化している(→π電子となり、π結合を形成している)ことが分かります。
この考え方は、第104回の問7で「インドール」が登場した際に解説しました。
4(ピリジン)と5(ピリジンのプロトン化体)は、π電子の数が6個です。
4の非共有電子対はsp2軌道に入っているので、π電子ではありません。
これについては、第104回の問7で「ピリミジン」が登場した際に解説しました。
さて、今度は「② その環が平面構造である」という条件について見ていきましょう。
2〜5の化合物は、環状に非局在化した π電子を6個もち、かつ、5員環もしくは6員環が平面構造をとっています。
したがって、2〜5の化合物は、すべて芳香族性を示します。
1のペンタジエニルカチオンも平面構造です。
しかし、前述のとおり、①の条件を満たしていないので芳香族性を示さないのです。
正解は1ですね。
芳香族性を示すためには、①と②の条件をともに満たす必要があるので、ご注意ください。
②の条件を満たしてはいるのに、①の条件を満たしておらず、芳香族性を示さない化合物としては、例えば、次の[10]アヌレンが挙げられます。
この化合物は、4n+2のnが2ですが、2つの水素原子(H)がぶつかってしまうため、平面構造を取ることができません。

---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198920.html)
【薬剤師国家試験 第103回 問6,7,9】置換基の命名・絶対立体配置・亜鉛の酸化数
今回から、第103回の薬剤師国家試験に入ります。
必須問題の問6,7,9は比較的簡単なので、一気に解説しますね(問8は次回です)。

置換基の命名に関する問題ですね。
「2-メチルブチル基」ということなので、ブチル基の2番目にメチル基をくっつければいいだけですね。
置換基の付け根から数えることが重要なポイントです。

5番の選択肢が正解です。
この問題は簡単でしたね。
それでは、このまま次の問7に進みましょう。

不斉炭素原子の絶対立体配置がRなのかSなのかを決定する問題です。
まずは、不斉炭素原子に結合している4つの置換基に優先順位をつけましょう。
次に、優先順位がもっとも低い置換基(この問題ではH)を奥側にします。
1番目→2番目→3番目の順にたどっていき、時計回りだった場合はR、反時計回りだった場合はSです。
ちなみに私は、時計回りだったら現実(Real)の世界なので、「R」。
そうでないなら、Sと覚えています。
R体は5番ですね。

最後に、問9を解説しますね。

生体内において、亜鉛イオンとともに働いる酵素があるんでしたね。
亜鉛の酸化数は0もしくは2+です(他の酸化数は見たことがありません……)。
高校化学のボルタ電池やダニエル電池で、下記の式を覚えたのではないでしょうか?
Zn → Zn2+ + 2e–
以上、簡単に解ける3問でした。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198920.html)
【薬剤師国家試験 第104回 問213】なぜプロドラックにしているのかを考えよう
問213は、バラシクロビルに関する問題です。
この問題で第104回薬剤師国家試験の解説を終わりにします。
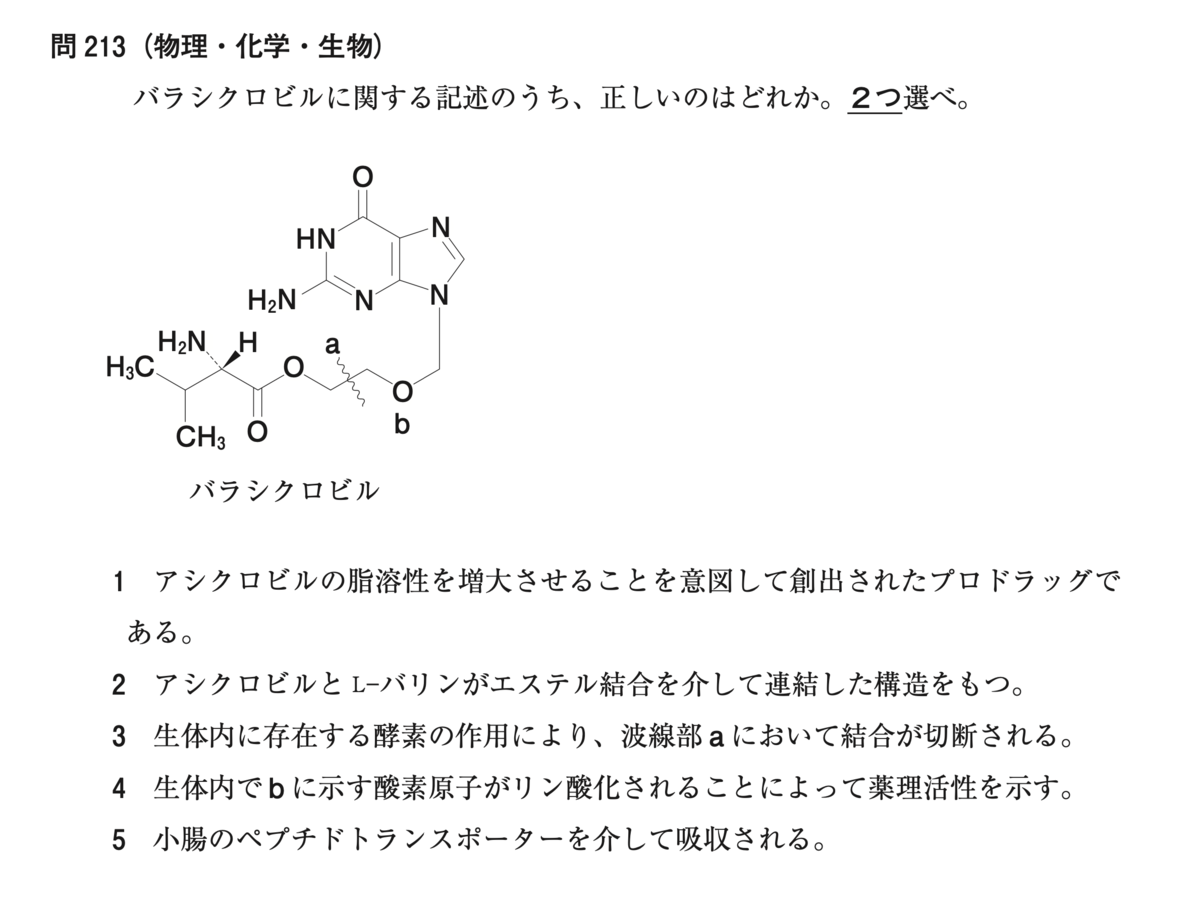
【1】……バラシクロビルがプロドラッグであるならば、生体内で構造のどこかが変わるはずです。
プラスグレルの代謝の第一段階もそうでした(第114回、問209)。
下に示したようにエステル構造が加水分解されて、活性をもつ化合物になるのでしょう。

プロドラッグであることはもっともらしいのですが、この設問の「脂溶性を増大させることを意図して」という記述が正しいとは思えません。
なぜなら、エステルのカルボン酸側にアミノ基が置換しているからです。
第1級アミンは、カルボン酸ぐらい水溶性が高くなるはずです。
「脂溶性を増大させることを意図して」という記述は誤りなので、×です。
【2】……L-バリンかD-バリンかは、Fischer投影式で判断できますね。
カルボキシル基を上側にして、アミノ基が手前側に向くようにします。
このとき、アミノ基が左側にあるとL-アミノ酸、右側にあるとD-アミノ酸です。
図が示すとおりL-バリンなので、【2】の記述は正しいです。

【3】……生体内だろうとフラスコの中だろうと、C–C結合を切断するのは難しいですよね。
この記述は、×です。
ちなみに、C–C結合を切断するのが難しいと言っても、第104回の問102【5】で登場した逆アルドール反応や、過ヨウ素酸ナトリウムを用いた酸化など、例がないわけではありません。

【4】……リン酸化されるということは、アルコールからリン酸(モノ)エステルができるということです。

下記のようにエーテル酸素がリン酸エステルの構造に変換されることはありません。
酸素原子が正電荷を帯びてしまいますよね。

そのため、【4】の記述は×です。
リン酸化されるとしたら、エーテル酸素ではなく水酸基のほうでしょう。*1

【5】……プロドラック化された理由が、脂溶性を上げるためではなく、ペプチドトランスポーターを通過させるためというのであれば頷けます。
プロドラック化するために導入した構造はバリン(=アミノ酸)ですからね。
以上のことから、正解は【2】と【5】でした。
アミノ基が置換しているにもかかわらず、「脂溶性を増大させることを意図して」……という【1】の記述が誤りであると気づくことができれば、正解にたどりつけそうです。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
*1:実際はリン酸が3つ結合するそうです(アシクロビル三リン酸)。
【薬剤師国家試験 第104回 問211】 水溶性が高くなるかどうかを考えよう
問211は、前問に引き続き、生体内で医薬品がどのように変換されるのかを考える問題です。

今度は排泄に関する変換ですね。
問題文のとおり、基本的に医薬品は、生体内で水溶性の高い化合物に変換されてから排泄されるんでしたよね。
尿の主成分は水ですからね。
水溶性を高める必要があることは容易に想像できます。
それでは、各設問を1つずつ見ていきましょう。
【1】……アセタール構造とは、下に示した部分のことですよね。
アセタールが開裂したら、水酸基が2つも生じるので水溶性が高くなります。
【1】は○ですね。
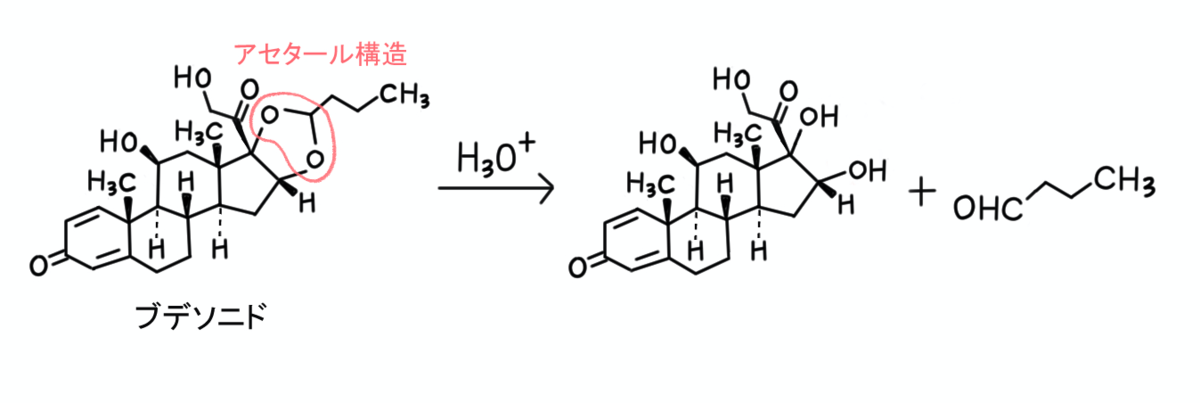
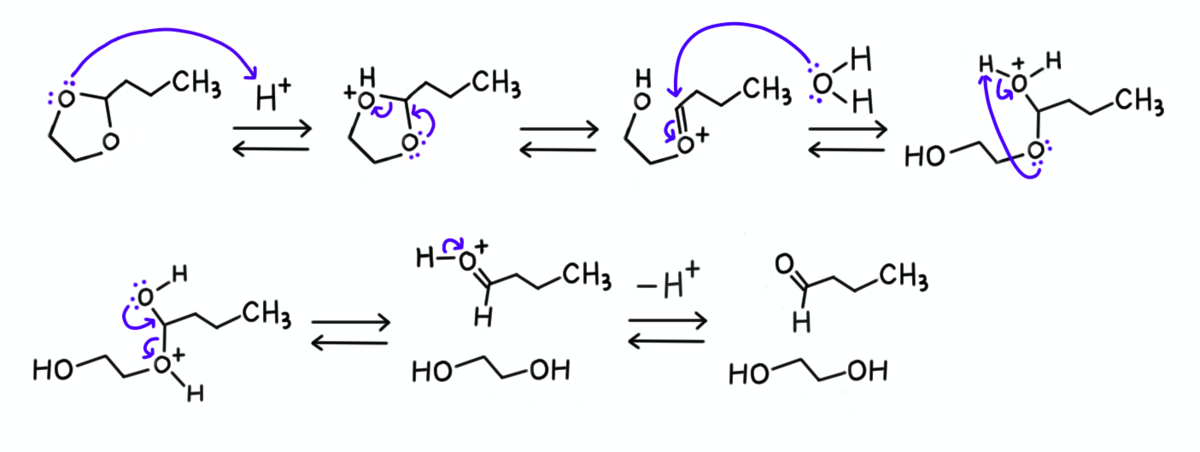
ついでに、必要な部分の構造だけ書き出して、反応機構を示しておきます。
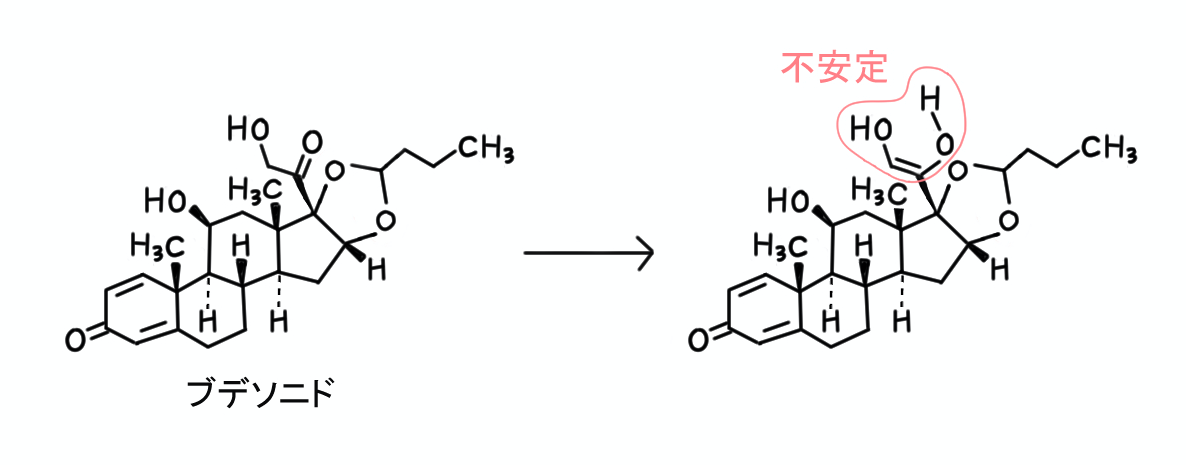
【2】……ケトンが互変異性化すると、エノール構造が生じます。
水酸基が1つ増えるので水溶性が高くなりそうですが、そもそもエノール構造が不安定なため、この構造のままでいることが難しいでしょう(存在比率がとても小さい)。
【2】の記述は×です。
【3】……そもそも、有機化合物の二重結合が還元されたら、水溶性が高くなるものなのでしょうか?
二重結合の有無と水溶性には関係がなさそうです。
余談ではありますが、二重結合があるかどうか、または二重結合の数が関係しているものと言えば、油脂の性状ですよね。
動物性の油脂(=脂肪)と植物性の油脂(=油)が固体なのか液体なのかは、二重結合の数が関係しているんでした。
この記述は×です。
【4】……水酸基がなくなってしまったとしたら、水溶性は下がってしまいます。
この記述も×です。
【5】……酸化されたらアルデヒドになりますね。
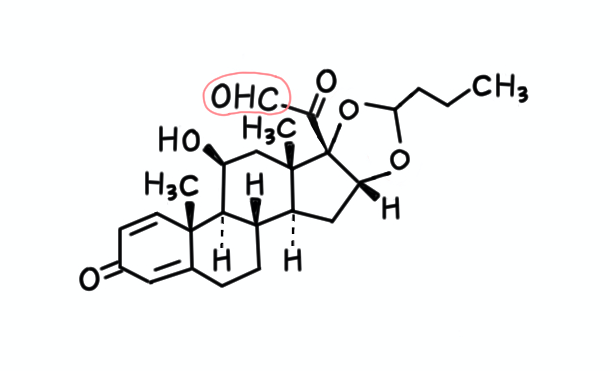
しかしながら、水酸基がアルデヒドになってしまったら、水溶性は下がってしまいます。
CとOより、OとHの方が、電気陰性度の差が大きいですからね(CとOは二重結合なので、単純な比較はできませんが)。
ただし、カルボン酸まで酸化されるのであれば話は別です。
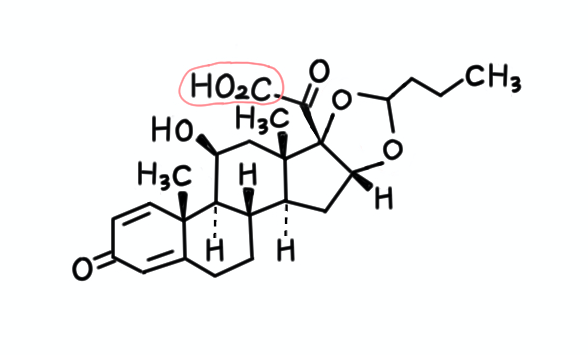
カルボン酸は、アルデヒドはもちろん、アルコールよりも極性が高いです。
分極どころか、プロトンを放出してイオン性の化合物になりますよね。
設問【5】の「酸化される」が、アルデヒドへの酸化なのか、それともカルボン酸まで酸化されるのかが判断できませんね。
【5】は保留にしておきましょう。
というわけで、明らかに正しい記述は【1】のみですね。
【5】の設問については、生体内で21位の水酸基がカルボン酸まで酸化されることはないということのなのかもしれません。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問209】プロドラッグが生体内でどのように変換されるのかを考えよう
プラスグレルという医薬品の代謝経路に関する問題ですね。
問題文から、この医薬品はプロドラッグであることが分かります。
スキームを見てみると、三段階の変換を経て活性代謝物になるようです。
それでは、各段階で何が起こっているのか確認していきましょう。

 最初の段階では、プラスグレルのアセチル基が除去され、代謝物Aに変換されていますね。
最初の段階では、プラスグレルのアセチル基が除去され、代謝物Aに変換されていますね。
生体内でエステルが加水分解される場合、「エステラーゼ」という酵素が働いている可能性が高いでしょう。

ちなみに、油脂は生体内で「リパーゼ」という酵素によって加水分解されるんでしたよね。
本質的にはこの反応と同じことです。

続いて、チオフェンの骨格が変換され、代謝物AからBが生じています。
水酸基がカルボニル基に変わっており、一見するとAが酸化されたように見えますが、巻き矢印を書いてみると互変異性体であることが分かります。
互変異性化は酸化剤や還元剤を必要としないので、酸化反応でも還元反応でもありません。

最後の段階では、カルボニル基の炭素原子と硫黄原子をつなぐ結合が切断されていますね。
結合が切断されるのと同時に、硫黄原子にHが、カルボニル基にOHがくっついています。
したがって、この段階は加水分解です。
生体内でこのような工程を経て、活性をもつ化合物に変換されるわけです。
それでは、各設問を見ていきましょう。
【1】……「チエノピリジン系医薬品」かどうかを聞かれています。
「ピリジン」の構造を下に示しました。

この構造は、プラスグレルに含まれていますよね。
芳香環ではありませんが、六員環であることと、六角形を構成する原子の1つが窒素原子であることが同じです。
「チエノ」はいかにも硫黄が入ってそうです(チエノ = thieno = thio(硫黄を表す) + ene(二重結合)?)。
しかしながら、先述のとおりプラスグレルの窒素原子を含む六員環は芳香化していません(二重結合が2つありません)。
そのため、もしかしたら「テトラヒドロチエノピリジン系医薬品」かもしれませんね。
【1】の設問は、保留にしておきましょう。
【2】……「プロテアーゼ」はペプチド結合(アミド結合)を切断する酵素です。
酵素の名前(プロテアーゼ→プロテイン)から、タンパク質と関係があることが伺えますよね。
この記述は×です。
上記のとおり、この段階は「エステラーゼ」が働くのでしょう。
【3】……上記の説明のとおり、この段階は互変異性化です。
互変異性体ですので、○です。
【4】……代謝物Bにジアステレオマーが存在するかどうか聞かれています。
ある化合物にジアステレオマーが存在するかどうか確認する際は、不斉炭素原子が2個以上あるのかどうか確認しましょう。*1
図に示した位置に2つの不斉炭素原子が存在しますので、○です。

ただし、対称構造をもつ化合物の場合は「メソ体」が存在する可能性もありますので、ご注意ください(メソ体については、第104回の問207、選択肢【5】を参考にしてください)。
【5】……医薬品の構造から、活性が発現するメカニズムを推測する問題のようです。
ご存知のとおり医薬品は、低分子が受容体や酵素と相互作用したり、DNAにインターカレーションしたりして活性が生じるわけですよね。
この設問は、活性代謝物Cと標的タンパク質が共有結合するのかどうかを聞いています。
タンパク質の構造の中で、医薬品と共有結合する官能基(アミノ酸残基)として知られているのが、メルカプト基(–SH、システイン残基)です。
この官能基は、別の分子のメルカプト基とジスルフィド結合(-S–S-)を形成します。
この際には酸化剤を必要とし、 還元剤が作用すると元どおりになります。

パーマをかける際に、髪の毛のタンパク質(ケラチン)のジスルフィド結合を一度切り(1液、還元剤)、再び結合させる(2液、酸化剤)話は有名ですよね。
そのため、メルカプト基をもつプラスグレルは、標的タンパク質と共有結合を形成してもおかしくはありません。
ただし、メルカプト基をもつからといって、共有結合を形成するとは限らないので、この設問は保留にしておきます。
各設問を通してみると、【2】のプロテアーゼの記述が明らかに×なので、正解するのは簡単ですね。
ということは、【1】 と【5】は◯だったんですね。
余談ではありますが、タンパク質と共有結合を形成することにより活性を発現する医薬品といえば、エノン構造をもつ「アファチニブ」も有名ですよね。
EGFR(上皮成長因子受容体)のシステイン残基が反応し、共有結合を形成します(1,4-付加 or Michael付加)。

---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
*1:不斉炭素原子以外にも、軸不斉やキラルスルホキシドをもつ化合物の場合は、それらもカウントします。
【薬剤師国家試験 第104回 問207】化学の考え方とシスプラチンの知識で解こう
今回から実践問題(有機化学限定)に入ります。
かつての薬剤師国家試験(〜96回まで)には、この手の問題は少なかったですね……。
私は医療現場で働いた経験がありませんが、化学の力で実践問題を解いてみますね!
 【1】……錯体は配位子交換しますよね。
【1】……錯体は配位子交換しますよね。
シスプラチンが思い出されます。

問題になっているオキサリプラチンも配位子交換しそうですが、二座で配位子しているので(キレートしているので)、シスプラチンより安定していそうです。
どちらとも言えないので、【1】は保留にしておきましょう。
【2】……この設問は、Pt–O結合が切れやすいのか、Pt–N結合が切れやすいのかを聞いていますね。
金属原子は基本的に電気陰性度が低く、酸素原子や窒素原子は高いですよね。
結合エネルギーは、電気陰性度の差がより大きい、Pt–Oの方が高くて外れにくそうです(結合エネルギー: Pt–O > Pt–N)。
ただし、じつは前の問題で、点滴静注液と書いてありました。

静脈に入れるということなので、水溶液中の話をしています(血液の成分はほとんどが水)。
水分子のような極性が高い溶媒の下では、電気陰性度の差から考えた結合の強さとは逆転しますよね(極性溶媒中での結合の切れにくさ: Pt–N > Pt–O)。*1
したがって、×です。
【3】……配位子交換も化学反応です。
反応条件次第で起こりやすさは変わるでしょうから、○です。
【4】……この設問の記述は、シスプラチンが活性を示すためのメカニズムですよね。
オキサリプラチンとシスプラチンの構造は類似しており、活性のメカニズムに大きな違いがあるとは思えないので、○でしょう。
【5】……有機化学の問題が決ましたね。
これはチャンスですので、慌てずに配位子Bの構造、および、鏡に映した構造を書いてみましょう。

この2つの構造は、重なり合いませんよね。
これらはエナンチオマーに相当します。
続いて、配位子Bがシンの配置になっている構造を書いてみましょう。
アンチの配置があれば、シンの配置の化合物もあります。
こちらに関しても、鏡に映した構造を書いておきます。

シン配置の場合、上記の2つの構造は重なり合いますよね。
両者は同じ立体異性体です。
不斉炭素原子を(2つ以上)もつにもかかわらず、対称構造をもっているため、エナンチオマーが存在しないんでしたね。
メソ体と呼ばれています。
酒石酸がメソ体の化合物として有名です。
この設問は、○です。
最後まで解いてみると、【1】か【2】かな……というところです。
化学的には【2】の記述が間違いだと言えるので、正解は【2】でしょう(当たっていました)。
ということは、【1】の記述は合っており、配合変化を受けるということですね(これは知らないと難しい……)。
とても難しい問題でしたが、化学の考え方(【2】、【3】、【5】)と、シスプラチンに関する知識(【4】)を勉強していれば、正解にたどり着けそうです。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
【薬剤師国家試験 第104回 問106】NMRの問題を解くときは構造を省略せずに書こう
問106は、NMRの問題です。


問題文に記載されている示性式のような構造を見ながら解いていくと、分かりにくくて間違えるリスクが高いです。
まずは化合物を構造式に書き直しましょう。
このとき、Hを省略したり、メチル基を「Me」にしたりせずに、構造がはっきりと分かるように書きましょう。
問題文からは、E体とZ体のどちらかは判断できません(桂皮酸がE体であると知っているのであれば話は別ですが)。

【1】……1 ppm付近にあるのは、たいてい飽和炭化水素の部分(アルキル基)ですね。
しかも、電子求引性基や電子供与性基が直接置換していない部分です。
問題の構造式を見てみると、2つのメチル基がこのピークに相当することが分かります。
隣の炭素に水素が1つ置換していますので、n+1個、つまり2つに割れます(二重線)。
2つのメチル基は等価であり、同じ位置に検出されるため6H分です。*1
以上のように、1.3 ppm付近のピークは6H分の二重線なので、【1】の記述は×です。
【2】……5.2 ppm付近のピークは五重線として記録されていますよね。
共役系がつながっているからか、随分と低磁場シフトしていますが、割れ方からして、オレフィンの水素ではなくメチン水素でしょう。
この化合物のオレフィン水素のピークは、基本的には2つに割れるはずであり、五重線になることはありません。
それに対し、イソプロピル基のメチン水素のピークは、両隣のメチル基の影響で対称的に数多く割れるはずですからね。
理論的にはn+1で七重線です。

このピークは(pdfファイルを拡大しても)五重線に見えるのですが、理論的には七重線です。
この設問は保留にしておきましょう。
【3】……二置換オレフィンにおいて、結合定数が6〜12 HzであればZ体、14〜18 HzであればE体です。
この記述は明らかに○です。
【4】……この辺りの複雑なピークは芳香環の水素のものですね。
一置換のベンゼンなので、芳香環の水素は全部で5H分あるはずです。
もっとも低磁場のところにあるピークは、(基本的には)シャープな二重線ですので、芳香環の水素ではなさそうです。
ベンゼン環のHのピークは下に示した結合定数に従って割れるので、シャープな二重線にはなりませんよね(後述するように、低磁場側のオレフィン水素のピークは、ベンゼン環の水素とのスピン結合もありそうですが)。

面積的に偏っていることから積分値を判断するようですね。
2つの複雑な形をしたピークは、おおよそ2Hと3H分でしょうか?
問題で指し示しているのは面積が小さい側のピークなので、2H分でしょう。
したがって、【4】の設問は×ですね。
積分記号がないので、ピークの大きさから面積を判断するようですね。
【5】……最も低磁場のピークが、問題の化合物のどのHなのかを考えてみましょう。
オレフィン水素の一方が、まだ登場していないですよね。
最も低磁場のピークは、この水素の1H分です。
よく見てみると、シャープな二重線ではなく、さらに小さく割れていますよね。
これは、芳香環とのスピン結合だと思います(下図で赤く示したところ)。
このように、4本分の結合が離れている原子ともスピン結合するのですが、その値は小さく、0のときもあります。

最も低磁場にあるピークが、本当にオレフィン水素のものなのか? 少々複雑なのでベンゼン環の水素のものではないのか?……と、思ってしまうので、問題の難易度を上げていますよね。
ちなみに、このオレフィン水素が非常に低磁場シフトしていることも、間違えてしまう要因になっていますよね。
フェニル基が隣にあることに加えて、オレフィンを挟んで共役しているカルボニル基の影響も受けて、低磁場にシフトしているのでしょう。
【5】も×です。
以上のことから、問106の正解は【3】です。
【2】は○か×か判断できなかったのですが、【3】が明らかに○なので、×なのでしょう。
生チャートのピークがどう見えるかというよりは、理論的には何重線で検出されますか?……と聞いている問題だったようです。
【2】の設問だけでなく、問106は全体的に難問でしたね。
ベンゼン環〜オレフィン〜カルボニル基の共役系の影響で、ケミカルシフトの値がオーソドックスな値からズレていることも難問になっている要因です。
有機系の研究室でNMRチャートに慣れていないと難しいと思います(実際に、この問題は正答率が低いようですね)。
---
興味のある方は是非どうぞ↓
問題の出典: 厚生労働省ホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198921.html)
*1:ちなみに、分子内に不斉炭素原子があると、非等価に(別々のピークとして)検出されます。